高二化学第二学期期中试卷B
高 二 化 学
考生须知:
1.全卷分试卷Ⅰ、Ⅱ和答卷Ⅰ、Ⅱ,试卷共6页,有4大题35小题,满分为100分,考试时间90分钟。
2.本卷答案必须写在答卷Ⅰ、Ⅱ的相应位置上,直接做在试卷上无效。
3.请用钢笔或蓝、黑圆珠笔将班级、姓名、学号、试场号、座位号分别填写在答卷Ⅰ、Ⅱ的相应位置上。考试结束后只需上交答卷Ⅰ、Ⅱ,考试时不能使用计算器。
4.本卷可能采用的相对原子质量:H-1,C-12,O-16, Na-23,Mg-24,Al-27,
S-32, Fe-56
第Ⅰ卷(选择题,共56分)
一、选择题(每小题只有一个选项符合题意,共56分)
1.为了科学地饮食,了解一些与食品相关的化学知识是必要的。油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装。下列气体中最适宜充入的是
A.氮气 B.二氧化碳 C.空气 D.氧气
2.常用于浸制生物标本的福尔马林属于
A.纯净物 B.混合物 C.化合物 D.单质
3.设NA为阿伏加德罗常数,下列说法中不正确的是
A.2.3g金属钠变为钠离子时失去的电子数是0.1NA B.32g氧气所含原子数为2NA
C.0.5NA个氯分子所占体积约为11.2L D.18g水所含的质子总数为10NA
4.在强酸性溶液中,可以大量共存的离子组是
A.Na+、K+、CH3COO—、Cl— B.Ba2+、Na+、CO32—、NO3—
C.Na+、Ag+、SO42—、Cl— D.Al3+ 、Fe3+、NO3—、SO42—
5.下列各组液体混合物中,能用分液漏斗分离的是
A.乙醇和水 B.苯和苯酚
C.乙醛和乙酸 D.乙酸乙酯和饱和碳酸钠溶液
6.下列各组性质的比较中,不正确的是
A.原子半径:Cl > S B.热稳定性:NH3 > PH3
C.金属性:K > Na D.碱性:NaOH > Mg(OH)2
7.既能与盐酸反应,又能与NaOH溶液反应的是
A.Fe B.Al(OH)3 C.MgO D.AlCl3
8.下列对于实验室事故的处理,合理的是
A.苯酚沾在手上,立即用氢氧化钠溶液洗涤 B.金属钠失火,立即用泡沫灭火器灭火
C.酒精灯失火后,立即用水扑灭 D.不慎将烧碱溶液溅到皮肤上,立即用水冲洗
9.下列说法中,正确的是
A.在周期表里,元素所在的周期数等于原子核外电子层数
B.在周期表里,主族元素所在的族序数等于原子核外电子数
C.最外层电子数为8的粒子是稀有气体元素的原子
D.元素的原子序数越大,其原子半径也越大
10.下列叙述中正确的是
A.H2SO4的摩尔质量是98
B.1mol氢气的体积肯定是22.4L
C.500mL硫酸溶液中,含硫酸98g,其物质的量浓度为2mol/L
D.等质量的CO和CO2中所含碳原子个数相等
11.下列各组物质互为同分异构体的是
A.氕、氘 B.乙酸、甲酸甲酯 C.乙烷、丙烷 D.金刚石、石墨
12.下列溶液中,阴离子物质的量浓度最大的是
A.0.5mol/L H2SO4溶液50mL B.0.6mol/L Al2(SO4)3溶液35mL
C.0.8mol/L NaCl溶液80mL D.0.7mol/L Na2CO3溶液60mL
|
A.N、P、O、C B.C、N、O、P
C.O、S、N、F D.C、Si、Al、N
14.下列物质中,既有离子键又有共价键的是
A.H2O B.CaCl2 C.KOH D.C12
15.下列有关厨房铝制品的使用与洗涤中,你认为合理的是
A.盛放食醋 B.烧煮开水 C.用金属丝擦表面的污垢 D.用碱水洗涤
16.下列物质中,其分子式为C6H14的是
A.2-甲基丁烷 B.2,3-二甲基戊烷 C.2-甲基己烷 D.2,3-二甲基丁烷
17.在一定条件下,SO2和O2在一密闭容器中进行反应,下列说法中错误的是
A.反应开始时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后为零
C.随着反应的进行,逆反应速率逐渐增大,最后不变
D.随着反应的进行,正反应速率逐渐减小,最后不变
18.下列电离方程式书写正确的是
A.NaOH
![]() Na+
+ OH- B.Na2SO4
== Na2+ + SO42-
Na+
+ OH- B.Na2SO4
== Na2+ + SO42-
C.CH3COOH
![]() H+
+ CH3COO- D. H2CO3
==2H+ + CO32-
H+
+ CH3COO- D. H2CO3
==2H+ + CO32-
19.苯与乙烯、乙炔比较,下列叙述中正确的是
A.都易发生取代反应 B.乙炔、乙烯易燃烧、苯不易燃烧
C.都易发生加成反应 D.乙烯和乙炔能被酸性高锰酸钾溶液氧化,而苯不能
20.下列反应中,有沉淀产生且不会消失的是
A.向NaOH溶液中逐滴滴入Fe2(SO4)3溶液直至过量
B.将NaOH溶液逐滴滴入AlCl3溶液中,直至过量
C.向AlCl3溶液中逐滴滴入稀硫酸
D.将氨水逐滴滴入硝酸银溶液中,直至过量
21.下列说法中正确的是
A.可逆反应的特征是反应物和生成物的浓度相等
B.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动
C.在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化学平衡状态
D.在其他条件不变时,增大压强一定会破坏有气体参加的化学反应的平衡状态
22.苯分子中的两个氢原子被氯原子取代后,生成的同分异构体有
A.一种 B.二种 C.三种 D.四种
23.某有机物的结构简式为![]() 下列对其化学性质的判断中,不正确的是
下列对其化学性质的判断中,不正确的是
A.能被银氨溶液氧化
B.能使KMnO4酸性溶液褪色
C.1mol该有机物只能与1molBr2发生加成反应
D.1mol该有机物只能与1molH2发生加成反应
24.下列物质中不属于醇类的是
A.C6H5OH B.C6H5CH2OH C.C3H7OH D.HOCH2CH2OH
25.人造地球卫星用到一种高能电池——银锌蓄电池,其电极反应式为:
Zn+2OH—-2e—==ZnO+H2O,Ag2O+H2O+2e—==2Ag+2OH—。据此判断氧化银(Ag2O)是
A.负极,被氧化 B.正极,被还原 C.负极,被还原 D.正极,被氧化
26.下列反应既属于氧化还原反应,又是吸热反应的是
A.灼热的炭与CO2的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
 C.铝片与稀盐酸的反应 D.甲烷在氧气中的燃烧反应
C.铝片与稀盐酸的反应 D.甲烷在氧气中的燃烧反应
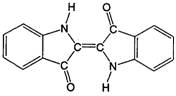
27.历史上最早应用的还原性染料——靛蓝,其结构简式如右图所示,下列关于靛蓝的叙述中不正确的是
A.它是不饱和的有机物 B.它的分子式是C16H10N2O2
C.该物质是高分子化合物D.靛蓝由碳、氢、氧、氮四种元素组成
28.在铁的氧化物和氧化铝组成的混合物中,加入2mol/L硫酸溶液65mL,恰好完全反应。所得溶液中Fe2+能被标准状况下112mL氯气氧化。则原混合物中金属元素和氧元素的原子个数之比为
A.5 : 7 B.4 : 3 C.3 : 4 D.9 : 13
第Ⅱ卷(非选择题,共44分)
二、填空题(本大题包括3小题,共20分)
29.(10分)(1)写出乙醛溶液和新制Cu(OH)2悬浊液共热的化学方程式 ▲ ;
(2)写出乙醇在浓硫酸作催化剂的条件下,加热到170℃生成乙烯的化学方程式
▲ ,该反应属于 ▲ 反应;
(3)写出Al和NaOH溶液反应的离子方程式 ▲ ;
(4)配平化学方程式(在空格内填入化学计量数):
□Cu + □HNO3 = □Cu(NO3)2 + □NO↑+ □H2O;
30.(6分)〔本题包括2小题,每位同学只需选做一小题,若两题都做,按第(1)小题积分〕
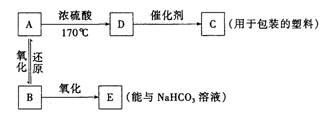
(1)已知B可以发生银镜反应,D气体密度是氢气的14倍。根据下列图示:
试写出A、B、C的结构简式:A ▲ 、B ▲ 、C ▲ 。
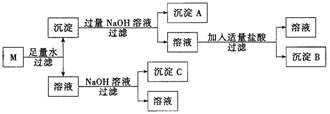 (2)某混合物M,含有MgCl2、Al2O3,和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
(2)某混合物M,含有MgCl2、Al2O3,和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
试写出沉淀A、B、C的化学式:A ▲ 、B ▲ 、C ▲ 。
31.(4分)(1)实验室配制FeCl3溶液时,常常由于Fe3+的水解而致使溶液产生浑浊,请你分析产生这种现象的原因是 ▲ (用离子方程式表示),现欲配得澄清的FeCl3溶液,可以采取的方法是 ▲ ;
(2)我们每天吃的食物,都直接或间接地来自绿色植物的光合作用制造的有机物,现有如下反应:6CO2 + 12H2O ![]() C6H12O6
+ 6H2O + 6O2(正反应为吸热反应),为提高农作物产量可采用的方法很多,如利用塑料薄膜大棚种植农作物,能取得良好的增产效果。根据上述反应,请你从化学平衡移动原理的角度,提出在大棚种植中使农作物增产的两条措施:
C6H12O6
+ 6H2O + 6O2(正反应为吸热反应),为提高农作物产量可采用的方法很多,如利用塑料薄膜大棚种植农作物,能取得良好的增产效果。根据上述反应,请你从化学平衡移动原理的角度,提出在大棚种植中使农作物增产的两条措施:
① ▲ ;② ▲ 。
三、实验题(本大题包括2小题,共12分)
32.(2分)下列实验操作的正确的是 ▲ 。
A.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯;
B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,验证乙醇能否被氧化为乙醛;
C.向某未知溶液中先加入稀硝酸酸化后,再加入Ba(NO3)2溶液,检验是否含SO42-;
D.向试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,然后加热制取乙酸乙酯;
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动。
F.用已知物质的量浓度的HCl溶液(标准液)滴定未知物质的量浓度的NaOH溶液(待测液)时,将酸式滴定管用蒸馏水洗涤干净,然后直接把标准液装入滴定管中。
33.(10分)氨(NH3)是重要的含氮化合物。1774年该气体由英国普里斯特里利用熟石灰和氯化铵加热反应制成。
(1)写出实验室制取氨气的化学方程式 ▲ ;
(2)为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置:
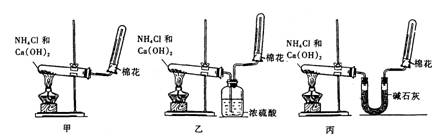
实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”) ▲ ;
(3)如何检验氨气是否收集满(简述操作方法、现象和结论) ▲ ;
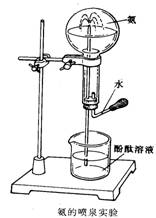 (4)该实验装置与实验室制备 ▲ 气的装置相同.;
(4)该实验装置与实验室制备 ▲ 气的装置相同.;
(5)如右图在圆底烧瓶里收集干燥的氨气。挤压胶头滴管中的
少量水,使它射入烧瓶中,接着你会观察到的现象是 ▲ ,
该现象说明氨气具有的性质是 ▲ , ▲ ;
(6)有同学用氨的喷泉实验装置做喷泉实验,但实验失败,
请分析实验失败的可能原因 ▲ (写出任何一个合理
答案即可)。
四、计算题(本大题包括2小题,共12分)
34.(5分)某气态烃A,其密度是相同状况下氢气密度的22倍,燃烧0.2摩尔A能生成0.6摩尔二氧化碳。通过计算确定该烃的分子式,并写出该烃的结构简式。
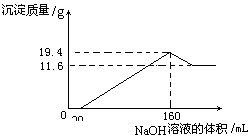 35.(7分)将一定质量的镁铝合金全部溶于
35.(7分)将一定质量的镁铝合金全部溶于
100 mL某浓度的盐酸中。向所得溶液中滴
加5.0mol/L的NaOH溶液,生成沉淀质量
与加入的NaOH溶液体积关系如右图所示。
求:(1)19.4g沉淀中含有Al(OH)3的质量;
(2)盐酸的物质的量浓度。