高二化学测试题
 可能用到的原子量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27
可能用到的原子量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27
S-32 Cl-35.5 Ca-40 Zn-65 Ba-137 Fe-56
一、 选择题(每题只有一个正确选项,每题2分,共40分)
1、2004年4月15日重庆发生的氯气泄漏事故、2004年4月20日江苏扬州发生的氨气泄漏事故再一次给安全生产敲响了警钟。下列关于氯气和氨气的说法中正确的是
A.氯气和氨气都是易液化的气体
B.氯气和氨气都是无色、密度比空气大的有毒气体
C.氯气和氨气都是由极性键构成的非极性分子
D.氯气和氨气分子中所有原子都满足最外层为8电子结构
2、既能用浓H2SO4干燥,又能用P2O5干燥的气体是
(A)SO2 (B)H2S (C)NH3 (D)HI
3、下列事实中,能说明氮的非金属性比磷强的是:①硝酸的酸性比磷酸强②NH3比PH3稳定性强③硝酸显强氧化性④在常温下氮单质为气体,磷单质为固体⑤NH3易溶于水而PH3难溶于水
A、只有①②④ B、只有②③⑤ C、只有①② D、全部
4、已知元素砷(As)的原子序数为33,下列叙述正确的是
A.砷元素的最高化合价为+3 B.砷元素是第五周期的主族元素
C.砷原子的第3电子层含有18个电子 D.砷的氧化物的水溶液呈强碱性
5、关于氮族元素(由N到Bi)的单质及其化合物的性质递变规律,下列说法正确的是
A.单质的熔、沸点依次增大 B.单质磷的还原性比氮气强
C.气态氢化物的还原性依次减弱 D.磷酸的酸性比硝酸强
6、下列制取气体的方法在实验室不可取的是
⑴铜和稀硝酸反应,排空气法收集NO ⑵锌和稀硝酸反应制氢气
⑶氮气和氧气反应制NO ⑷加热氯化铵制取氨气
A.⑴⑵ B.⑵⑶ C.⑴⑵⑷ D.全部
7、任何铵盐都具有的性质是
①都溶于水 ②常温都是固体 ③都有氨的刺激性气味 ④加热后都放出氨气 ⑤与强碱混合加热都有氨气放出 ⑥加热后都会分解
A.①②③④ B.①②⑤⑥ C.①③⑤⑥ D.②④⑤⑥
8、氢化铵(![]() )与氯化铵的结构相似,又知
)与氯化铵的结构相似,又知![]() 与水反应有
与水反应有![]() 生成,下列叙述不正确的是
生成,下列叙述不正确的是
A. ![]() 是离子化合物
是离子化合物
B. ![]() 溶于水,所形成的水溶液显酸性
溶于水,所形成的水溶液显酸性
C. ![]() 与水反应时,
与水反应时,![]() 是还原剂
是还原剂
D. ![]() 固体投入少量水中,有两种气体产生
固体投入少量水中,有两种气体产生
9、浓硝酸久置,往往会呈现黄色,要消除浓硝酸的黄色而尽量不改变其浓度可行的方法是
A. 煮沸 B. 加足量水 C. 通入空气 D. 加入氢氧化钠溶液
10、 用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成CuO,CuO再与稀硝酸反应。下列有关叙述不正确的是
A.所消耗的硝酸的量:①>②>③
B.对环境造成的危害,③最小
C.因铜与浓硝酸作用最快,故制取硝酸铜的最佳方案是①
D.三种途径所消耗的铜的质量相等
11、 某无色混合气体,依次通过浓硫酸和过氧化钠,气体体积不断减少,颜色变深,则混合气体组成是
A.H2O(g)、NO和N2 B.NO2、CO2和H2O(g)
C.O2、HCl和CO D.NH3、NO和CO2
12、 相同状况下,3个烧瓶内分别充满干燥的NH3、HCl、NO2气体。然后分别用水作喷泉实验,实验结束后,烧瓶内3种溶液的物质的量浓度之比为
A.3﹕3﹕2 B.2﹕2﹕3 C.1﹕1﹕1 D.无法比较
13、 决定化学反应速率的最本质的因素是
A.温度 B.反应物的性质 C.催化剂 D.温度或压强
14、 在一定温度下,可逆反应:A(g)+3B(g) Û 2C(g)达平衡状态的标志是
A、C生成的速率与C分解的速率相等
B、单位时间生成nmolA,同时生成3nmolB
C、 A、B、C的浓度相等
D、A、B、C的分子数比为1:2:3
15、
已知反应![]() 在某段时间内以A的浓度变化表示的化学反应速率为1
在某段时间内以A的浓度变化表示的化学反应速率为1 ![]() ,则此段时间内以C的浓度变化表示的化学反应速率为
,则此段时间内以C的浓度变化表示的化学反应速率为
A.0.5 ![]() B.1
B.1 ![]()
C.2 ![]() D.3
D.3 ![]()
16、 下列事实中不能用勒沙特列原理来解释的是
A. 合成氨在高压下进行是有利的
B. 温度过高对合成氨不利
C. 使用催化剂能使合成氨速率加快
D. 及时分离从合成塔中出来的混合气,有利于合成氨
17、
可逆反应SO2+NO2
![]() SO3+NO达到平衡时,其它条件不变,通入O2,则平衡
SO3+NO达到平衡时,其它条件不变,通入O2,则平衡
A.正向移动 B.逆向移动
C.不移动 D.先正向后逆向移动
18、 在一定温度下的定容密闭容器中,当下列物理量不再改变时,表明反应:
![]() A(s)+2B(g) C(g)+ D(g),已达平衡的是 ①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量
A(s)+2B(g) C(g)+ D(g),已达平衡的是 ①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量
A、①② B、②③ C、①③ D、④
19、
在一定的温度下, 将a mol PCl5通入一个容积不变的反应器中, 达到如下平衡: PCl5(气) ![]() PCl3(气) + Cl2(气), 测得平衡混合气体的压强为P1, 再向反应器中通入a mol的PCl5, 在温度不变的条件下再度达到平衡状态, 测得压强为P2, 则P1和P2的关系应是下列中的
PCl3(气) + Cl2(气), 测得平衡混合气体的压强为P1, 再向反应器中通入a mol的PCl5, 在温度不变的条件下再度达到平衡状态, 测得压强为P2, 则P1和P2的关系应是下列中的
A. 2P1 > P2 B. 2P1 = P2 C. 2P1 < P2 D. P1 < P2
20、
在![]() 反应中,若有
反应中,若有![]() 被氧化,则反应用去的氯气在标准状况下体积为
被氧化,则反应用去的氯气在标准状况下体积为
A. 5.04L B. 6.72L C. 20.16L D. 40.32L
二、填空题(5道大题,共52分)
21、
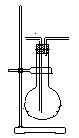 (12分)利用右图装置收集以下8种气体,烧瓶的位置不能变化①H2 ②Cl2 ③SO2 ④H2S ⑤NH3 ⑥NO ⑦HCl ⑧CH4 (左边长导管为A, 右边长导管为B.)
(12分)利用右图装置收集以下8种气体,烧瓶的位置不能变化①H2 ②Cl2 ③SO2 ④H2S ⑤NH3 ⑥NO ⑦HCl ⑧CH4 (左边长导管为A, 右边长导管为B.)
(1)若烧瓶是干燥的,由B进气可收集的气体有 A B
(2)若烧瓶是干燥的,由A进气,可以收集的气体有
(3)若烧瓶充满水,可收集的气体有 ,这时气体
由 进入。
(4)若在烧瓶内装浓硫酸,进行气体干燥,这时气体由 进
入,不能用此装置来干燥的气体有 。
22、 (8分)亚硝酸钠(NaNO2)又称工业盐,其外观类似食盐,但有剧毒。近年来,建筑工地多次发生民工误食工业盐而中毒的事件。利用如下反应可鉴别NaNO2和NaCl。
___KMnO4+___NaNO2+___H2SO4==___MnSO4+___K2SO4+___NaNO3+___H2O
(1)配平上述反应的化学方程式;并标出电子转移的方向和数目。
(2)指出该反应的氧化剂 ;
(3)当有2mol电子转移,则有 mol还原剂被氧化。
23、
 (13分)(1) 实验室制取氨气有几种方法:
(13分)(1) 实验室制取氨气有几种方法:
① 当用NH4Cl和Ca(OH)2来制取氨气时应选用装置是
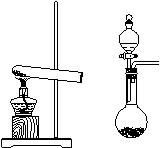 ______ ,反应的化学方程式为:
______ ,反应的化学方程式为:
_________________________________ 。
② 当用浓氨水和NaOH固体来制取氨气时应选用装置
______ ,用有关方程式和必要文字说明其原理:
__________________________________________________
|
|
(2) 实验室收集氨气时应选用的方法是__________________。
(3) 如何检验氨气是否已收集满,写出正确的操作方法:____________ _____
_ 。
(4) 氨的催化氧化是工业制取硝酸的基础,写出该反应的化学反应方程式:
____ ________。
24、
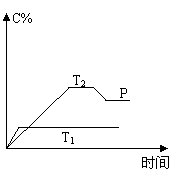 (10分)在一定条件下,可逆反应A + B
(10分)在一定条件下,可逆反应A + B ![]() Mc
Mc
变化如右图所示。已知纵坐标表示在不同温度和压强下生
成物C在混合物中的质量分数,P为反应在T2温度时达到
平衡后向容器加压的变化情况,问:
(1)温度T1 T2(填大于、等于或小于)
(2)正反应是 反应(填“吸热”或“放热”)
(3)如果A、B、C均为气体,则m 2(填大于、等于或小于)
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强 ,平衡 移动。
25、 (9分)A.B.C.D.E分别为(NH4)2SO4、NH4Cl、NaCl、Na2SO4、Ba(OH)2五种溶液中的某一种,把它们两两混合:
⑴A和B混合产生白色沉淀,加热后无明显变化;
⑵B和C混合产生白色沉淀,加热后产生使湿润红色石蕊试纸变蓝的气体;
⑶B和E混合无明显变化,加热后产生使湿润红色石蕊试纸变蓝的气体。
根据以上现象:
①判断A.B.C.D.E各为什么物质(填化学式):
A B C D E
②写出下列物质间反应的离子方程式
A+B :
B+C :
三、 计算题(请写出计算过程,本题8分)
26、铜跟50 mL 2 mol/L的硝酸溶液反应,反应停止后,溶液质量增加了1.32 g。求(1)至少加入多少克铜?(2)反应后溶液中硝酸根离子和氢离子的物质的量浓度各是多少?