高二化学(理科)下学期期终考试试卷B
注意:1.本试卷分必答题100分和附加题20分两部分,满分120分。时量90分钟。
2.可能用到的相对原子质量: H: 1 N: 14 O: 16 Mg: 24 Fe:56 Al:27 Cl:35.5 S:32 C:12
Ⅰ · 必答题(1-30题,共100分)
一、选择题(本大题有10小题 ,每小题2分,共20分。每小题只有一个选项符合题意。答案请填入答案栏内)
1.关于氮族元素的下列叙述中不正确的是
A.原子最外层都有5个电子,位于周期表中VA族
B.锑和铋有比较明显的金属性
C.最高正价与负价的绝对值之差为2
D.H3ASO4的酸性比H3PO4的强
2.下列气体遇空气易变成红棕色的是
A. N2 B.NO2 C. NO D. NH3
3.决定反应速率的根本因素是
A.反应物本身的性质 B.浓度 C.温度 D.催化剂
4.在CH3COOH溶液中存在平衡CH3COOHH+ +CH3COO -,要使平衡向右移动,应加入的下列物质是
A.NaOH B. HCl C.CH3COONa D. NaCl
5.下列关于某些物质水解的叙述正确的是
A.Cu2+ 水解呈碱性 B.Fe3+水解呈酸性
C.S2-水解呈酸性 D.SO2-4水解呈中性
6.工业上由含钒、铬和锰的矿物冶炼难熔金属钒、铬和锰等,通常采用的方法是
A.碳还原 B.铝热法
C.活泼金属置换盐酸溶液中的金属 D.热分解法
7.要使溶液中的Al3+全部变为沉淀,最好选用的试剂是
A.NH3·H2O B.NaOH C.KOH D.Ba(OH)2
8.下列关于铁的叙述错误的是
A. 我国掌握冶铁技术的年代至少是春秋战国 B. 铁单质的颜色为银白色
C. 位于元素周期表第4周期第Ⅷ族 D. 铁制容器能存放硫酸硐溶液
9. 为了减少大气污染,许多大城市推广使用清洁汽车燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气,另一类是液化石油气。这两类燃料的主要成分都是
A、碳氢化合物 B、一氧化碳 C、氢气 D、醇类
10.下列烷烃的命名正确的是
A.3—甲基丁烷 B.2—乙基丁烷
C.2.3—二甲基丁烷 D.3.4—二甲基丁烷
二、选择题(本大题有10小题 ,每小题3分,共30分。每小题只有一个选项符合题意)
11.下列各种有机物中,一氯化物有三种沸点的是
A、CH3CH2CH3 B、(CH3)2CHCH2CH3
C、C6H6 (苯) D、(CH3)3CCH2CH3
12.下列各反应属于氧化反应的是
A.乙炔通入酸性KMnO4溶液,溶液褪色
B.乙烯通入溴水,溴水褪色
C.乙烯一定条件合成聚乙烯
D.苯在一定条件下与H2作用,生成环已烷
13.将Al片和Cu片用导线相连,一组插入浓HNO3溶液中,一组插入稀NaOH溶液中,分别形成了原电池,则在这两个原电池中,正极分别为
A.Al片、Cu片 B.Cu片、Al片 C.Al片、Al片 D.Cu片、Cu片
14.一定温度下,反应N2+3H2 ![]() 2NH3达到平衡状态标志的是
2NH3达到平衡状态标志的是
A.C(N2): C(H2): C(NH3)= 1:3:2
B.N2、H2和NH3的质量分数均不再改变
C.n ( N2 ) + n ( H2 ) = 2n ( NH3)
D.单位时间里每增加1molN2,同时增加3molH2
15.在某温度时,测得纯水中的C( H+ )=2.4×10-7mol·L-1,则C(OH-)为
A. 2.4×10-7mol·L-1 B. 0.1×10-7mol·L-1
C. ![]() mol·L-1 D.
C( OH- )无法确定
mol·L-1 D.
C( OH- )无法确定
16.Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授荣获了1998年诺贝尔医学奖。关于NO的下列叙述不正确的是
A、NO可以是某些含低价N物质氧化的产物 B、NO不是亚硝酸酸酐
C、NO可以是某些含高价N物质还原的产物 D、NO是红棕色气体
17.取两份铝粉,分别加入足量的浓NaOH溶液和足量的盐酸中,若反应产生的气体的质量比为2:1,则这两份铝粉的质量比为
A、2:1 B、1:2 C、2:3 D、3:4
18.将盛有氮气和二氧化氮混合气体的试管倒位于水中,经过足够时间后,试管内气体体积缩小为原体积的一半,则原混合气体中氮气和二氧化氮的体积比是
A、1:1 B、1:2 C、1:3 D、3:1
19.P2O5可用作干燥剂,但下列气体不能用P2O5干燥的是
A 、O2 B、CO2 C、Cl2 D、NH3
20.下列有关物质用途的说法不正确的是
A、乙烯是一种植物生长调节剂,可用作果实催熟剂
B、聚氯乙稀薄膜可用作食品包装
C、氧炔焰可用来焊接或切割金属
D、重油减压蒸馏后得到的沥青用于筑路
三、填空与简答(本大题有8小题,共 33分)
21.(4分)铁丝在Cl2中燃烧,生成 色的烟,将烟溶于适量水中生成 色溶液。向此溶液中加入足量氨水得到 色沉淀,过滤、干燥后放入坩埚中燃烧,得到的红棕色粉末物质是 。
22、(4分)在重铬酸钾的稀溶液中,存在下列平衡关系:
Cr2O2-7(橙红) + H2O![]() 2CrO2-4(黄色) + 2H+
2CrO2-4(黄色) + 2H+
(1)向该稀溶液中放入NaOH溶液,溶液呈 色,因为
。
(2)向已加入NaOH溶液的(1)中再加入过量稀硫酸,则溶液呈 色,因为 。
23.( 5分)附图所示的各步反应中,反应物A是日常生活中最常见的金属之一,生成物E是白色沉淀,分别指出A、B、C、D、E各是什么物质。(填化学剂)
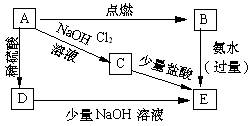
A、 ; B、 ;
C、 ;D、
E、 。
24.(4 分)分子式为C4H8的稀烃有3种同分异构体,其结构简式分别为
CH3-CH2-CH=CH2和_________________________, 。
25.(4 分)烷烃的通式是 ,烷烃分子中每增加一个碳原子,其相对分子质量就增加 。
26.(4 分)有一种常用的电池是锂电池(锂是一 种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年,它的负极用金属锂制成,电池总反应可表示为Li+MnO2 = LiMnO2 。试回答:锂电池比容量特别大的原因是 。锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因 。
27.(4 分)在浓硝酸中加入铜片:
(1)开始反应的化学方程式为
(2)若铜有剩余,则反应将要结束时的反应方程式是
28、(4分)常用于鉴别苯和甲苯的试剂是 。TNT是一种烈性炸药,广泛用于国防、开矿、筑路等。工业上用甲苯跟硝酸和浓硫酸的混和酸反应来制取,试写出其发生反应的化学方程式 。
四、实验题(本大题有2小题,共 11分)
29.(3分)某学生中和滴定实验的过程如下:(a)取一支碱式滴定管,(b)用蒸馏水洗净;(c)随即加入待测的NaOH溶液;(d)记录液面刻度读数;(e)用酸式滴定管精确放出一定量标准酸液,(f)置于未经标准酸液润洗的洁净锥形瓶中,(g)加入适量蒸馏水,(h)加入酚酞试液2滴,(i)滴定时,边滴边摇荡,(j)边注视滴管内液面的变化,(k)当小心滴到溶液由无色变成粉红色时,即停止滴定,(1)记录液面刻度读数,(m)根据滴定管的两次读数之差得出NaOH溶液体积为22mL。指出上述实验过程中的错误之处(用编号表示) 。
30.(8分)相同的反应物在不同的反应条件下,可能产生不同的产物。图3是实验室制取乙烯的装置。本实验在反应物确定以后,制得产物的关键是控制反应温度。如果温度为170℃,那么产物是乙烯;若温度为140℃,则产物为乙醚。
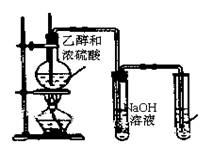 (1)写出制取乙烯的化学方程式
。
(1)写出制取乙烯的化学方程式
。
(2)A装置的烧瓶中除了盛装乙醇和浓H2SO4外还需要加入的固体是 ,其作用是 。
(3)为了制得乙烯,必须加热使液体混合物的 A B C 温度 170℃,并注意控制好温度,使乙烯均匀地产生。
(4)某学生用该装置进行实验时,没有观察到C装置中
的红棕色溴水褪色,分析产生这一现象的可能原因是 (填标号)。
a、乙烯未经过干燥 b、乙烯不能跟溴水反应
c、乙烯跟溴水反应的产物也呈红棕色 d、装置的反应温度在140℃左右
(5)在制取乙烯的反应中,浓硫酸所起的作用是 。
(6)B装置中NaOH溶液的作用是 。
五、计算题(本大题共6分)
31.有一3L的密闭容器中盛有N2和H2,在一定条件下发生反应,经过一段时间后达到化学平衡,此时容器中含有0.8molN2,1.2molH2和2molNH3,求:
(1)起始时N2和H2的物质的量浓度。(2)H2的转化率。
(3)设平衡时与起始时温度和容积不变,则平衡时与起始时容器内压强之比为多少?
Ⅱ、附加题(共20分)
32、已知氨气跟氧化铜反应可以制备氮气(2NH3+3CuO![]() 3Cu
+3H2O+N2↑),纯氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即反应生成氢氧化镁和氨气。
3Cu
+3H2O+N2↑),纯氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即反应生成氢氧化镁和氨气。
(1)下面是某化学课外小组的同学提出的实验室制备氨气的几种方案
A、硫酸铵固体与消石灰共热 B、浓氨水逐滴加到新制的生石灰中
C、在一定条件下,氮气与氢气化合 D、加热分解氯化铵固体
你认为其中较简单易行的方案有 (填字母);其反应的化学方程式为 。
(2)该小组同学设计的制备氮化镁的方案有以下两个,分别见实验方案的装置图(夹持及加热仪器没有画出)。且在实验前系统内的空气均已排除。
[方案一]

A B C D E F
①该实验完成后,能否得到纯净的氮化镁 (填“能”或“不能”);简述理由 。
②装置C的作用是 。
[方案二]已知:6NH2
+3Mg![]() 3Mg(NH2)2
+3H2↑
3Mg(NH2)2
+3H2↑
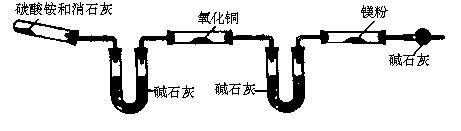
A B C D E F
①该方案中存在的主要问题是 。
②如何才能解决上述问题 。
高二化学(理科)参考答案
一、选择题(20分)
1、D 2、C 3、A 4、A 5、A 6、B 7、A 8、D 9、A 10、C
二、选择题(30分)
11、D 12、A 13、B 14、B 15、A 16、D 17、A 18、C 19、D 20、B
三、填空与简答(33分)
21、(4分)棕 浅绿 红褐 Fe2O3
22、(4分)(1)黄,上述平衡向右移动,生成较多的CrO2-4
(2)橙红,加入酸后平衡向左移动,生成较多的Cr2O2-7
23、(5分)A、Al B、AlCl3 C、NaAlO2 D、Al2(SO4)3 E、Al(OH)3
![]() 24、(4分)CH3—CH = CH—CH3
CH2 =
C—CH3
24、(4分)CH3—CH = CH—CH3
CH2 =
C—CH3
CH3
25、(4分)CnH2n+2 14
26、(4分)等质量时锂的物质的量比其他金属的要大,放电量也大,所以锂电池的比容量特别大;锂是活泼金属,锂可与水反应:2Li + 2H2O = 2LiOH + H2↑
27、(4分)(1)Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+2H2O
(2) 3Cu + 8HNO3(稀) = 3Cu (NO3)2 + 2NO↑+4H2O
28、(4分)酸性KMnO4
![]()
![]()
![]()
![]()
![]()
![]() CH3+ 3HNO3
O2N
NO2
+ 3H2O
CH3+ 3HNO3
O2N
NO2
+ 3H2O
四、实验题 NO2
29、(3分)C、J、K
30、(8分)(1)CH3CH2OH![]() CH2
= CH2 + H2O (2分)
CH2
= CH2 + H2O (2分)
(2)碎瓷片 防止沸体瀑沸
(3)迅速上升 (4)d (5)催化剂、脱水剂
(6)除去杂质气体SO2等
五、计算题
31、(6分)
(1)C(N2)为0.6mol/L C(H2)为1.4mol/L
(2)71.43% (3)2∶3
附加题(20分)
32、(1)(8分)A、B (NH3)2SO4 +Ca(OH)2 =CaSO4 + 2NH3↑+2H2O
NH3·H2O + CuO = NH3↑+Ca(OH)2
(2)(6分)①不能,由于反应器F与空气相通,生成氮化镁后会与水反应而带入Mg(OH)2
②防倒吸、缓冲气流
(3)(6分)
①在气体进入反应器E之前没有除去NH3、NH3会与Mg反应而带入杂质。
②在D和E之间加一个盛有浓H2SO4的洗气瓶。