高二化学(选修)第一学期期中试卷
可能用到的相对原子质量:H~1 C~12 N~14 O~16 Na~23 Mg~24 Al~27
Cl~35.5 Br~80 I~127 Ag~108
第Ⅰ卷
(选择题答案涂在读题卡上)
一、选择题(本题共8小题,每小题2分,计16分,每小题只有一个正确答案。)
1.简单原子的原子结构可用下图形象地表示:
![]()
其中![]() 表示质子或电子,
表示质子或电子,![]() 表示中子,则下列有关①②③的叙述正确的是
表示中子,则下列有关①②③的叙述正确的是
A、①②③互为同位素 B、①②③互为同素异形体
C、①②③是三种化学性质不同的粒子 D、①②③具有相同的质量数
2.下列物质属于原子晶体的化合物是
A、金刚石 B、石墨 C、二氧化硅 D、干冰
3.下列分子中中心原子的杂化轨道类型与其他三个都不一样的是
A、HCN B、CO2 C、BeCl2 D、PCl3
4.下列分子互为等电子体的是
A、H2O和NH3 B、N2和CO C、SiO2和O3 D、NO2和CO2
5.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
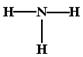
A、一个D2O分子所含的中子数为8 B、NH3的结构式为
![]() C、HCl的电子式为
C、HCl的电子式为
D、热稳定性:H2S>HF
6.有关晶体的下列说法中正确的是
A、晶体中分子间作用力越大,分子越稳定
B、原子晶体中共价键越强,熔点越高
C、冰熔化时水分子中共价键发生断裂
D、氯化钠熔化时离子键未被破坏
7.有组成是CrCl3·6H2O的配合物,中心原子Cr3+的配位数为6,Cl—、H2O均可作配体,向含有0.1mol该配合物的溶液中,加入足量硝酸银溶液,共得到14.35g沉淀,则该配合物的化学式是
A、[Cr(H2O)6]Cl3 B、[Cr(H2O)4Cl2]Cl·2H2O
C、[Cr(H2O)5Cl]Cl2·H2O D、[Cr(H2O)3Cl3]·3H2O
8.下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)===CO2(g);△H1 C(s)+O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);△H4
③H2(g)+O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)===Ca(OH)2(s);△H8
A、① B、④ C、②③④ D、①②③
二、选择题(本题共8小题,每小题4分,计32分。每小题有1~2个正确答案)
9.配合物的空间构型和配位数之间有着密切的关系,配位数为4的配合物空间立体构型是
A、四面体 B、正八面体 C、平面四边形 D、三角形
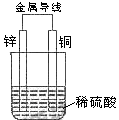 10. 关于如图所示装置的叙述,正确的是
10. 关于如图所示装置的叙述,正确的是
A、铜是阳极,铜片上有气泡产生
B、锌片质量逐渐减少
C、电流从锌片经导线流向铜片
D、氢离子在铜片表面被还原
11.一定能在下列溶液中大量共存的离子组是
A、pH=1的无色溶液中:NH4+、Mg2+、SO42-、Cl-
B、能使pH试纸变深蓝色的溶液中:Na+、AlO2—、S2—、CO32—
C、含有大量Fe3+的溶液:SCN—、I—、K+、Br—
D、澄清透明的无色溶液中:ClO—、MnO4—、Al3+、SO42—
12.下列变化规律与共价键键能大小有关的是:
A、F2、Cl2、Br2、I2的熔沸点逐渐升高
B、HF、HCl、HBr、HI的稳定性逐渐减弱
C、金刚石的硬度、熔点、沸点都高于晶体硅
D、NaF、NaCl、NaBr、NaI熔点依次降低
13.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol
②稀溶液,H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol
下列结论正确的是 ( )
A、碳的燃烧热大于110.5kJ/mol
B、①的反应热为221kJ/mol
C、稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D、稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
14.下列关于晶体的说法一定正确的是
A、第ⅠA碱金属元素与ⅦA元素所形成的化合物在固态时为离子晶体,晶体中阴、阳离子排列方式相同
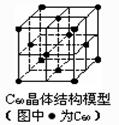 B、晶体中存在阴离子就必定存在阳离子,存在阳离子就必定存在阴离子
B、晶体中存在阴离子就必定存在阳离子,存在阳离子就必定存在阴离子
C、离子晶体中只含有离子键,分子晶体、原子晶体中必定含有共价键
D、C60晶体(其结构模型如右图)中每个C60分子周围与它距离最近且等距离的C60分子有12个
15.用两根金属铂做电极,以KOH溶液做电解质溶液,从两极分别通入CH4(g)和O2,则对该燃料电池的下列叙述中正确的是
A、负极的电极反应式为:CH4-8e-+10OH-=CO32-+7H2O
B、负极的电极反应式为:4OH-—4e-=2H2O+O2↑
C、标准状况下,通入5.6 LO2并完全反应后,有1.00mol电子转移
D、放电一段时间后,通入O2的电极附近溶液的pH降低
16.1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1mol C与O2反应生成CO的反应热△H为
A.-Y kJ/mol B.-(10X-Y) kJ/mol
C.-(5X-0.5Y) kJ/mol D.+(10X-Y) kJ/mol
高二化学(选修)第一学期期中试卷
 第Ⅱ卷
第Ⅱ卷
三、填空、简答题
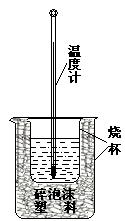
17.(5分)实验室利用如右图装置进行中和热的测定。回答下列问题:
①该图中有两处未画出,它们是 、 ;
②在操作正确的前提下提高中和热测定的准确性的关键是 ;
③如果用0.5 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将 (填“偏大”、“偏小”、“不变”);原因是 。
18.(4分)试用杂化轨道理论分析为什么BF3的空间构型是平面三角形,而NF3是三角锥形的?
19.(8分) PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
⑴ PtCl2(NH3)2是平面四方形结构,还是四面体结构
⑵ 请在以下空格内画出这两种固体分子的几何构型图:
淡黄色固体: , 黄绿色固体:
⑶ 黄绿色固体在水中溶解度比淡黄色固体大,原因是
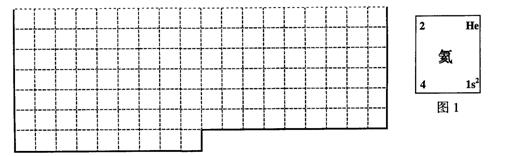 20.(13分)
20.(13分)
(1) 下表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
 (2) 元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。
(2) 元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。
(3) 元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:_____>_____
甲、乙的最高价氧化物水化物的酸性强弱为:________>________ (用化学式表示)。
(4) 在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是_____。
a.元素①的单质 b.元素②的单质 c.元素①②形成的合金 d.无法判断
⑸ 上图中③④⑤三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:__________________________________。
21.(12分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
⑴卤素互化物BrCl能发生下列反应
H2O+BrCl===HBrO+HCl
KBr+BrCl===KCl+Br2
① BrCl的电子式 ,它是由 键形成的 分子。
②写出KI与IBr反应的化学方程式:
。
③判断反应 “H2O+BrCl ”是否为氧化还原反应 _______。若是氧化还原反应,标电子转移方向和数目:
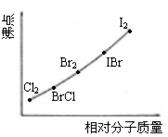
⑵右图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是________ ______。
⑶试推测ICl的沸点所处的最小范围_____ _________。
22.(10分)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。E的单质既能与强酸反应,也能与强碱反应。根据以上信息回答下列问题:
![]() (1)甲、乙两分子中含有非极性共价键的物质的结构式是______________________,C元素在周期表中的位置是__________________。
(1)甲、乙两分子中含有非极性共价键的物质的结构式是______________________,C元素在周期表中的位置是__________________。
(2)C和D的离子中,半径较小的是__________(填离子符号)。
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是____________________________________________________。
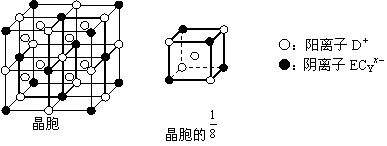
(4)C、D、E可组成离子化合物DxECY,其晶胞结构如上图所示,阳离子D+位于正方体的棱的中点和正方体内部;阴离子ECYx-位于该正方体的顶点和面心。该化合物的化学式是____________。
命题、校对:王宏斌