高二化学1 5分钟随堂训练3
2.1 化学反应速率
第三课时
1.煅烧硫铁矿产生SO2,为了提高生成SO2的速率,下列措施可行的是…………………( )
A.把块状矿石碾成粉末
B.向炉内喷吹氧气
C.使用Fe203作催化剂
D.降低体系的温度
2.升高温度时,化学反应速率加快,主要原因是……………( )
A.分子运动速率加快,碰撞机会增多
B.反应物分子能量增加,活化分子百分数增大,有效碰撞次数增多
C.该反应的过程是吸热的
D.该反应的过程是放热的
3.对于反应:NO+CO2![]() N02+CO在密闭容器中进行,下列哪些条件加快该反应的速率………………( )
N02+CO在密闭容器中进行,下列哪些条件加快该反应的速率………………( )
A.缩小体积使压强增大
B.体积不变充人CO2使压强增大
C.体积不变充人He气使压强增大
D.压强不变充入N2使体积增大
4.下列说法正确的是…………………………………………( )
A.合成氨反应使用催化剂使原来不能发生的反应变为可以发生的反应
B.增大压强对溶液的反应几乎没有影响
C.升高温度可以使放热反应速率增大,也可使吸热反应速率增大
D.如果反应是放热的,则反应开始时就不需要加热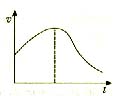
5.把镁条投入盛有盐酸的敞口容器中,产生H2的速率可用右图表示,在下列因素中:①盐酸的浓度 ②镁条的面积 ③溶液的温度 ④氯离子的浓度,影响反应速率的因素是( )
A.①④ B.③④
C.①②③ D.①②③④
6.对于一定条件下进行的化学反应,2SO2(g)+O2(g)![]() 2SO3(g)改变下列条件,可以提高反应物中的活化分子百分数的是( )
2SO3(g)改变下列条件,可以提高反应物中的活化分子百分数的是( )
A.升高温度 B.增大压强
C.使用催化剂 D.增大反应物浓度
7.某反应在催化剂的作用下按以下两步进行,第一步X+Y====Z;第二步为Y+Z====M+N+X。此反应的总的化学方程式是________,反应的催化剂是_________。
8.取2 g干燥的铝粉和干燥的3 g碘粉小心混匀,分为四堆。往各堆上分别加O.5 g水,1 g明矾,1 g胆矾,1 g无水CuSO4。加水那堆混合物首先冒火花,发生剧烈反应,其次发生反应的是加明矾的那堆,再次是加胆矾的一堆发生反应,而加无水CuSO4的那堆最难反应。
(1)铝和碘反应的方程式为__________________。
(2)铝和碘反应可观察到的现象是________________.
(3)四堆反应的先后顺序说明______________________.
第三课时
1.A 2.B 3.AB 4.BC 5.C 6.AC
7.2Y====M+N X
8.(1)2l+3I2====2AlI3 (2)紫色气体(3)水是催化剂,胆矾比明矾稳定