高二化学12月月考试题2
本卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。
可能用到的相对原子质量:
C:12 H:1 O:16 Mg:24 Al:27 Fe:56 S:32 Na:23 N:14 Cl:35.5
第Ⅰ卷(选择题)
一.选择题(每小题只有一个正确选项,每小题3分,共60分)
1.下列有关叙述中与甲烷无关的是: ( )
A.据报道,2005年7月11日,新疆某煤矿发生“瓦斯”爆炸,22人死亡。
B.国家“西部大开发”的重点工程——“西气东输”工程。
C.2004年夏,某女士在做饭使用液化气时不慎发生爆炸。
D.农村用秸秆、稻草等通过发酵制取的某种新能源——沼气。
2.有a、b、c、d四种金属,将a与b用导线连接起来,浸入电解质溶液中,b不易腐蚀;将a、d分别投入等浓度盐酸中,d比a反应激烈;将铜浸入b的盐溶液中,无明显变化;若将铜浸入c的盐溶液中,有金属c析出,据此判断它们的活动性由强到弱的顺序( )
A.dcab B.dabc C.dbac D.badc
3.制取Fe(OH )2并使之能久存,可采取的操作有:①加入一些植物油,②溶解FeSO4配成溶液,③把蒸馏水加热煮沸并密封冷却,④加入少量铁屑,⑤加入少量CCl4,⑥向FeSO4溶液中滴入足量氨水,⑦把盛有氨水的滴管伸入FeSO4溶液中后再挤出氨水。其中必须进行的操作及其正确顺序是( )
A.②④①⑦⑤ B.⑨②⑤⑥④ C.③②④⑤⑦ D.③②④①⑦
4.下列物质间反应, 其中水既不是氧化剂, 又不是还原剂的氧化还原反应是( )
 ①F2和H2O ②Na和H2O ③Na2O2和H2O ④P2O5和H2O ⑤Na2O和H2O ⑥Cl2和H2O ⑦NO2和H2O
①F2和H2O ②Na和H2O ③Na2O2和H2O ④P2O5和H2O ⑤Na2O和H2O ⑥Cl2和H2O ⑦NO2和H2O
A.③④⑤⑥⑦ B.①⑤⑦ C.②③⑤ D.③⑥⑦
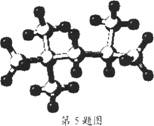
5."辛烷值"用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,右图是异辛烷的球棍模型,则异辛烷的系统命名为( )
A.1,1,3,3-四甲基丁烷 B.2,2,4-三甲基-戊烷
C.2,4,4-三甲基戊烷 D.2,2,4-三甲基戊烷
6.CH3CH(C2H5)CH(CH3)2的名称是 ( )
A.1,3-二甲基戊烷 B.2-甲基-3-乙基丁烷 C.3,4-二甲基戊烷 D.2,3-二甲基戊烷
7.美国正在研究用锌电池取代目前广泛使用的蓄电池,它具有容量大、污染小的特点,其电池反应为:2Zn+O2=2ZnO ,其原料为锌、空气和电解质溶液,则下列叙述正确的是( )
A.锌为正极,空气在负极反应 B.负极还原反应,正极氧化反应
C.负极的电极反应为:Zn-2e- + 2OH-== ZnO+H2O D.电池工作时溶液的pH降低
8.下列说法正确的是( )
A.分子组成相差一个或几个“—CH2—”原子团的物质互为同系物,它们有相似的化学性质和不同的物理性质。
B.不带支链的烃,其分子都是直线型的。
C.甲烷是烷烃中碳的含量最低的,也是最简单的烃。
D.相对分子质量相等的物质肯定是同分异构体。
9.已知C4H10的同分异构体有两种:CH3—CH2—CH2—CH3、![]() ,则C4H10的一氯代物的同分异构体共有( )
,则C4H10的一氯代物的同分异构体共有( )
A.l种 B.2种 C.3种 D.4种
10.下列离子方程式中正确的是 ( )
A.氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
B.Fe3+的检验:Fe3++3SCN-=Fe(SCN)3↓
C.向碳酸氢钙溶液中加入过量NaOH:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D.Na2S溶液呈碱性:S2-+H2O=HS-+OH-
11.两种气态烃以任意比例混合,在105℃时1 L混合烃与9 LO2混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L.下列各组混合烃中不符合此条件的是:( )
A.CH4,C2H4 B.CH4,C3H6 C.C2H4,C3H4 D.C2H2,C3H6
12.4mol甲烷与氯气发生取代反应,若生成相同物质的量的四种取代物,则消耗氯气的物质的量为 ( )
A.10mol B.20mol C.5mol D.8mol
13.如果定义有机物的同系列,为一系列结构式符合A(W)nB(其中n=0,1,2,3……)的化合物。式中A、B是任意一种基团(或氢原子),W为该同系列的系差。同系列化合物的性质往往呈现规律性变化。下列四组化合物中,不能称为同系列的是)( )
A.CH3CH2CH2CH3 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH3
B.CH3CH=CHCHO CH3CH=CHCH=CHCHO CH3 (CH=CH) 3CHO
C.CH3CH2CH3 CH3CHClCH2CH3 CH3CHClCH2CHClCH3
D.ClCH2CHClCCl3 ClCH2CHClCH2CHClCCl3 ClCH2CHClCH2CHClCH2CHClCCl3
14.一定温度下,将amolPCl5通入一个容积不变的反应器中,达到如下平衡:PCl5(g)![]()
PCl3(g)+Cl2(g),测得平衡混合气体压强为p1,此时再向反应器中通入amolPCl5,在不变的温度下再度达到平衡,测得压强为p2,下列判断正确的是( )
A.2 p1> p2 B.PCl5的分解率增大 C.2 p1< p2 D.PCl3%(体积含量)增大
15.当燃烧8.96L由CH4、CO、C2H6组成的混合气体时,除生成水外,还生成13.44LCO2气体(气体体积均在标准状况下测定)。则原混和气体中含C2H6的物质的量是:( )
A.0.2mol B.0.4 mol C.0.6 mol D.0.8 mol
16.硫酸镁、硫酸铝两种物质组成的溶液100mL中,SO42-物质的量浓度为0.20 mol/L,加入0.50 mol/L NaOH溶液100mL,生成的白色沉淀恰好不再溶解。过滤,在滤液中AlO2-物质的量浓度为
A.0.025 mol/L B.0.10 mol/L C.0.050 mol/L D.0.25 mol/L
17.将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是:( )
A.产物通过碱石灰,不能全被吸收,若通过浓硫酸,也不能被完全吸收。
B.产物的平均摩尔质量为24g/mol
C.若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则压强变为燃烧前的1/3
D.反应中消耗的氧气为56g
18.下列各组溶液中,仅用物质间相互反应不能一一区别的一组是:( )
A. Fe2(SO4)3、K2CO3、KHSO4、NH4Cl
B. NaOH、Na2CO3、Al2(SO4)3、MgCl2
C. AgNO3、NaCl、KCl、CuCl2
D. BaCl2、Na2SO4、(NH4)2SO4、KOH
19.某链状有机物分子中含有m个 —CH3 ,n个 —CH2— ,a个![]() ,其余为 —Cl,则—Cl的数目可能是:
( )
,其余为 —Cl,则—Cl的数目可能是:
( )
A.2n+3a-m B.a+2-m C.n+m+a D.a+2n+2-m
20.取0.2mol·L-1HX溶液与0.2mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH = 8,则下列说法(或关系式)正确的是:( )
A.混合溶液中由水电离出的c(OH¯)<0.2mol·L-1HX溶液中由水电离出的c(H+)
B.c(Na+) = c(X¯) + c(HX) = 0.2mol·L-1
C.c(Na+)-c(X¯) = 9.9×10-7mol·L-1
D.c(OH¯)+c(HX) = c(H+) = 1×10-8mol·L-1
第Ⅱ卷(非选择题)
21.(12分)实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是_______(填“Mg”或“Al”)片;铝片表面产生的气泡是__________;负极发生的反应是 。
(2)随后阶段,铝片发生的电极反应式是______________________________;镁条表面只有极少量的气泡产生,其原因之一是:2H++2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是:____________________ _____;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是
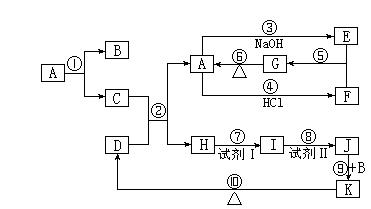 22.(18分)下列物质均为中学化学常见物质,转化关系如右图所示,已知D为红棕色粉末(反应条件及部分反应物、产物未全部标出)。
22.(18分)下列物质均为中学化学常见物质,转化关系如右图所示,已知D为红棕色粉末(反应条件及部分反应物、产物未全部标出)。
(1)写出下列物质的化学式:
A:_______;B:________; E:________; K:_________。
(2)C与D的混合物通常叫做________________ (填名称)。
(3)写出下列反应的化学方程式(注明反应条件,若是离子反应的写离子方程式):
②:__________________________________________________________________:
③:__________________________________________________________________:
⑤:__________________________________________________________________:
⑧:__________________________________________________________________:
23.(8分)写出下列烷烃的结构简式:
A.2-甲基戊烷 B.2-甲基-4-乙基庚烷
C.2,3,4,5-四甲基己烷 D.3,3-二乙基戊烷
24.(12分)将一块生锈铁片置于200mL稀HNO3中,反应结束后收集到1.12 L NO(标准状况),溶液中还剩下3 g单质铁。取出铁后,向溶液中通入10.65 g Cl2,恰好使溶液中Fe2+全部氧化(假设Cl2只与Fe2+ 反应)。求(1)原来这块生锈铁片中未被氧化的铁的质量。(2)原硝酸的物质的量浓度? (铁锈的成分为Fe2O3•H2O)
 高二化学12月月考试题
高二化学12月月考试题
答题卷 成绩
选择题答题处:(60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
非选择题
21.(12分)
(1)_______; ________; _______________________________________ 。
(2)________________________________;_________________________________。
________________________________;
22.(18分)
(1)A:__________; B:________;E:__________; K:_________
(2) ______________。
(3) ②_________________________________________________________________。
③_________________________________________________________________。
⑤_________________________________________________________________。
⑧_________________________________________________________________。
23.(8分)
|
24.(12分,写出计算过程)
| |
高二化学12月月考试题
本卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。
可能用到的相对原子质量:
C:12 H:1 O:16 Mg:24 Al:27 Fe:56 S:32 Na:23 N:14 Cl:35.5
第Ⅰ卷(选择题)
一.选择题(每小题只有一个正确选项,每小题3分,共60分)
1.下列有关叙述中与甲烷无关的是: ( )
A.据报道,2005年7月11日,新疆煤矿发生“瓦斯”爆炸,22人死亡。
B.国家“西部大开发”的重点工程——“西气东输”工程
C.2004年夏,某女士在做饭使用液化气时不慎发生爆炸。
D.农村用秸秆、稻草等通过发酵制取的某种新能源——沼气。
2.有a、b、c、d四种金属,将a与b用导线连接起来,浸入电解质溶液中,b不易腐蚀;将a、d分别投入等浓度盐酸中,d比a反应激烈;将铜浸入b的盐溶液中,无明显变化;若将铜浸入c的盐溶液中,有金属c析出,据此判断它们的活动性由强到弱的顺序( )
A.dcab B.dabc C.dbac D.badc
3.制取Fe(OH )2并使之能久存,可采取的操作有:①加入一些植物油,②溶解FeSO4配成溶液,③把蒸馏水加热煮沸并密封冷却,④加入少量铁屑,⑤加入少量CCl4,⑥向FeSO4溶液中滴入足量氨水,⑦把盛有氨水的滴管伸入FeSO4溶液中后再挤出氨水。其中必须进行的操作及其正确顺序是( )
A.②④①⑦⑤ B.⑨②⑤⑥④ C.③②④⑤⑦ D.③②④①⑦
4.下列物质间反应, 其中水既不是氧化剂, 又不是还原剂的氧化还原反应是( )
 ①F2和H2O ②Na和H2O ③Na2O2和H2O ④P2O5和H2O ⑤Na2O和H2O ⑥Cl2和H2O ⑦NO2和H2O
①F2和H2O ②Na和H2O ③Na2O2和H2O ④P2O5和H2O ⑤Na2O和H2O ⑥Cl2和H2O ⑦NO2和H2O
A.③④⑤⑥⑦ B.①⑤⑦ C.②③⑤ D.③⑥⑦
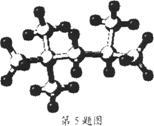
5."辛烷值"用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,右图是异辛烷的球棍模型,则异辛烷的系统命名为( )
A.1,1,3,3-四甲基丁烷 B.2,2,4-三甲基-戊烷
C.2,4,4-三甲基戊烷 D.2,2,4-三甲基戊烷
6.CH3CH(C2H5)CH(CH3)2的名称是 ( )
A.1,3-二甲基戊烷 B.2-甲基-3-乙基丁烷 C.3,4-二甲基戊烷 D.2,3-二甲基戊烷
7.美国正在研究用锌电池取代目前广泛使用的蓄电池,它具有容量大、污染小的特点,其电池反应为:2Zn+O2=2ZnO ,其原料为锌、空气和电解质溶液,则下列叙述正确的是( )
A.锌为正极,空气在负极反应 B.负极还原反应,正极氧化反应
C.负极的电极反应为:Zn-2e- + 2OH-== ZnO+H2O D.电池工作时溶液的pH降低
8.下列说法正确的是( )
A.分子组成相差一个或几个“—CH2—”原子团的物质互为同系物,它们有相似的化学性质和不同的物理性质。
B.不带支链的烃,其分子都是直线型的。
C.甲烷是烷烃中碳的含量最低的,也是最简单的烃。
D.常温时烷烃的同系物,只有四种呈气态。
9.已知C4H10的同分异构体有两种:CH3—CH2—CH2—CH3、![]() ,则C4H10的一氯代物的同分异构体共有( )
,则C4H10的一氯代物的同分异构体共有( )
A.l种 B.2种 C.3种 D.4种
10.下列离子方程式中正确的是 ( )
A.氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
B.Fe3+的检验:Fe3++3SCN-=Fe(SCN)3↓
C.向碳酸氢钙溶液中加入过量NaOH:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D.Na2S溶液呈碱性:S2-+H2O=HS-+OH-
11.两种气态烃以任意比例混合,在105℃时1 L混合烃与9 LO2混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L.下列各组混合烃中不符合此条件的是:( )
A.CH4,C2H4 B.CH4,C3H6 C.C2H4,C3H4 D.C2H2,C3H6
12.4mol甲烷与氯气发生取代反应,若生成相同物质的量的四种取代物,则消耗氯气的物质的量为 ( )
A.10mol B.20mol C.5mol D.8mol
13.如果定义有机物的同系一系列结构式符合A(W)NB(其中n=0,1,2,3……的化合物。式中A、B是任意一种基因(或氢原子),W为2价有机基团,又称为该同系列的系差。同系列化合物的性质往往呈现规律性变化。下列四组化合物中,不可称为同系列的是)( )
A.CH3CH2CH2CH3 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH3
B.CH3CH=CHCHO CH3CH=CHCH=CHCHO CH3 (CH=CH) 3CHO
C.CH3CH2CH3 CH3CHClCH2CH3 CH3CHClCH2CHClCH3
D.ClCH2CHClCCl3 ClCH2CHClCH2CHClCCl3 ClCH2CHClCH2CHClCH2CHClCCl3
14.一定温度下,将amolPCl5通入一个容积不变的反应器中,达到如下平衡:PCl5(g)![]()
PCl3(g)+Cl2(g),测得平衡混合气体压强为p1,此时再向反应器中通入amolP PCl5,在不变的温度下再度达到平衡,测得压强为p2,下列判断正确的是( )
A.2 p1> p2 B.PCl5的分解率增大 C.2 p1< p2 D.PCl3%(体积含量)增大
15.当燃烧8.96升由CH4、CO、C2H6组成的混和气体时,除生成水外,还生成13.44升CO2气体(气体体积均在标准状况下测定)。则原混和气体中含C2H6的物质的量是:( )
A.0.2mol B.0.4 mol C.0.6 mol D.0.8 mol
16.硫酸镁、硫酸铝两种物质组成的溶液100mL中,SO42-物质的量浓度为0.10 mol/L,加入0.30 mol/L NaOH100mL溶液到生成的白色沉淀恰好不再溶解为止。过滤,在所得滤液中AlO2-物质的量浓度为
A.0.025 mol/L B.0.10 mol/L C.0.050 mol/L D.0.25 mol/L
17.将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是:( )
A.产物通过碱石灰,不能全被吸收,若通过浓硫酸,也不能被完全吸收
B.产物的平均摩尔质量为24g/mol
C.若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则压强变为燃烧前的1/3
D.反应中消耗的氧气为56g
18.下列各组溶液中,仅用物质间相互反应不能一一区别的一组是:( )
A. Fe2(SO4)3、K2CO3、KHSO4、NH4Cl
B. NaOH、Na2CO3、Al2(SO4)3、MgCl2
C. AgNO3、NaCl、KCl、CuCl2
D. BaCl2、Na2SO4、(NH4)2SO4、KOH
19.某链状有机物分子中含有m个 —CH3 ,n个 —CH2— ,a个![]() ,其余为 —Cl,则—Cl的数目可能是:
( )
,其余为 —Cl,则—Cl的数目可能是:
( )
A.2n+3a-m B.a+2-m C.n+m+a D.a+2n+2-m
20.取0.2mol·L-1HX溶液与0.2mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH = 8,则下列说法(或关系式)正确的是:( )
A.混合溶液中由水电离出的c(OH¯)<0.2mol·L-1HX溶液中由水电离出的c(H+)
B.c(Na+) = c(X¯) + c(HX) = 0.2mol·L-1
C.c(Na+)-c(X¯) = 9.9×10-7mol·L-1
D.c(OH¯)+c(HX) = c(H+) = 1×10-8mol·L-1
第Ⅱ卷(非选择题)
21.(12分)实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是_______(填“Mg”或“Al”)片;铝片表面产生的气泡是__________;负极发生的反应是 。
(2)随后阶段,铝片发生的电极反应式是______________________________;镁条表面只有极少量的气泡产生,其原因之一是:2H++2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是:____________________ _____;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是
 22.(18分)下列物质均为中学化学常见物质,转化关系如右图所示,已知D为红棕色粉末(反应条件及部分反应物、产物未全部标出)。
22.(18分)下列物质均为中学化学常见物质,转化关系如右图所示,已知D为红棕色粉末(反应条件及部分反应物、产物未全部标出)。
(1)写出下列物质的化学式:
A:_______;B:________; E:________; K:_________。
(2)C与D的混合物通常叫做________________ (填名称)。
(3)写出下列反应的化学方程式(注明反应条件,若是离子反应的与离子方程式):
②:__________________________________________________________________:
③:__________________________________________________________________:
⑤:__________________________________________________________________:
⑧:__________________________________________________________________:
23.(8分)写出下列烷烃的结构简式:
A.2-甲基戊烷 B.2-甲基-4-乙基庚烷
C.2,3,4,5-四甲基己烷 D.3,3-二乙基戊烷
24.(12分)将一块生锈铁片置于200mL稀HNO3中,反应结束后收集到1.12 L NO(标准状况),溶液中还剩下3 g单质铁。取出铁后,向溶液中通入10.65 g Cl2,恰好使溶液中Fe2+全部氧化(假设Cl2只与Fe2+ 反应)。求(1)原来这块生锈铁片中未被氧化的铁的质量。(2)原硝酸的物质的量浓度? (铁锈的成分为Fe2O3•H2O)