实验班
氮族元素练习题(一)
班级_______姓名________得分________
1. 下列现象的产生与人为排放氮氧化物无关的是:
A. 闪电 B. 酸雨 C. 光化学烟雾 D. 臭氧空洞
2. 下列物质中是造成光化学烟雾主要因素的是:
A. N2 B. NO C. NO2 D. SO2
3. 下列各组两物质之间的关系,不属于同素异形体的是:
A. 氧气和臭氧 B. 白磷和红磷 C. 硅石和石英 D. 石墨和C60
4. 下列元素的原子中,原子半径最大的是:
A. N B. P C. F D. S
5. 能在空气中稳定保存的物质是:
A. 白磷 B. 亚硫酸钠 C. 硒化氢水溶液 D. 石英
6. 根据砷元素在元素周期表中的位置,推测砷元素单质及其化合物不可能具有的性质是:
A. 砷元素单质在通常情况下是固体 B. 砷元素有-3、+3、+5等多种化合价
C As2O5对应的水化物的酸性比磷酸强 D. 砷化氢不稳定
7. 下列有关氮气的叙述中错误的是:
A. 氮气可作贮存水果、粮食的保护气
B. 氮的非金属性比磷强,所以氮气的化学性质比磷活泼
C. 在雷雨天,空气中的N2和O2反应生成NO
D. 氮气既可作氧化剂,又可作还原剂
8. 氮族元素与同周期氧族元素及卤族元素比较,错误的是:
A. 原子半径小于同周期氧族元素及卤族元素的原子半径
B. 非金属性弱于同周期氧族元素及卤族元素
C. 气态氢化物的稳定性弱于同周期氧族元素及卤族元素的气态氢化物
D. 单质的氧化性弱于同周期氧族元素及卤族元素单质的氧化性
9. 关于氮、磷、硅的下列叙述中,错误的是:
A. 氮和磷是农作物生长的必需元素;单质硅是良好的半导体材料
B. 常温下,硅可以与氟气、强碱溶液起反应,氮气也能与氢气、氧气反应
C. 它们最高价氧化物对应水化物的酸性:HNO3>H3PO4>H2SiO3
D. 氢化物的稳定性:SiH4>PH3>NH3
10. 关于硫、磷、硅的下列叙述中,错误的是:
A. 磷是农作物生长的必需元素;硅是良好的半导体材料;硫在自然界中存在
B. 常温下,硅可以与氟气、强碱溶液起反应;磷和硫在足量氧气中点燃得到它们的最高价氧化物
C. 它们最高价氧化物对应水化物的酸性:H2SO4>H3PO4>H2SiO3
D. 氢化物的稳定性:SiH4>PH3>H2S
11. 下列各组中,离子能大量共存的是:
A. NH4+、Na+、SO42-、OH- B. NH4+、H+、Cl-、CO32-
C. K+、NH4+、NO3-、Cl- D. Fe2+、NH4+、NO3-、H+
12. 设NA代表阿佛加德罗常数,下列说法错误的是:
A. 12g C60中含有6NA个电子
B. 1mol HNO3见光分解,转移电子数4NA
C. 46g NO2和46g N2O4含有的原子数均为3NA
D. 60g SiO2与足量纯碱反应,高温下最多可释放出NA个气体分子
13. 下列离子方程式错误的是:
A. 少量二氧化硫通入漂白粉溶液中: Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
B. 把少量碳酸氢钠溶液加入到氢氧化钡溶液中: HCO3-+Ba2++OH-=BaCO3↓+H2O
C. NO2溶于水: 3NO2+H2O=2H++2NO3-+NO↑
D. 在NH4HSO4溶液中滴入等物质的量的NaOH溶液: NH4++OH-=NH3·H2O
14. 密闭的玻璃容器中用酒精灯加热下列物质,冷却后的物质其性质可能发生变化的是
A. 白磷 B. 氯化铵 C. 硅酸 D. 碘
15. 分离NaCl和NH4Cl的最佳方案是:
A. 加入烧碱 B. 利用溶解度不同,采用结晶法
C. 直接加热法 D. 加 AgNO3
16. 质量分数为30%的NH3·H2O与水等体积混合后,所得溶液质量分数:
A. 大于15% B. 等于15% C. 小于15% D. 无法确定
17. 氯水和氨水相比较,溶液中的微粒(离子、分子)种数:
A. 氯水=氨水 B. 氯水>氨水 C. 氯水<氨水 D. 无法判断
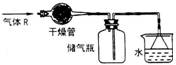 18. 在实验室里可按下图所示的装置来干燥、收集气体R,多余的气体可用水来吸收,则R是:
18. 在实验室里可按下图所示的装置来干燥、收集气体R,多余的气体可用水来吸收,则R是:
A. HCl B. NO
 C. NO2
D. NH3
C. NO2
D. NH3
19. 利用下列各组物质制备和收集相应的气体,适宜采用所示装置的是:① 二氧化锰和浓盐酸 ② 二氧化锰和双氧水 ③ 碳酸钙与稀硫酸 ④ 亚硫酸钠与浓硫酸 ⑤ NaOH固体和浓氨水:
A. ④ B. ②④
C ②④⑤ D. ①②③④⑤
20. 含下列某物质的硫酸铵,经测定含氮为20.16%,则这种硫酸铵中必含有:
A. NH4NO3 B. NH4HCO3 C. NH4Cl D. CO(NH2)2
21. (NH4)2Cr2O7是一种受热易分解的盐,下列各组对(NH4)2Cr2O7受热分解产物的判断,符合实际的是:
A. Cr2O3+N2+H2O B. CrO3+N2+H2O
C. Cr2O3+NH3+H2O D. CrO3+NO+H2O
22. 有可能混有下列物质的13.2g (NH4)2SO4样品,将该样品在加热条件下与过量NaOH溶液反应,可收集4.3L(标准状况)气体。则该样品中不可能含有的物质是:
A. NH4HCO3和NH4NO3 B. (NH4)2CO3和NH4NO3
C. NH4Cl和NH4HCO3 D. NH4Cl和(NH4)2CO3
23. 据最新消息,我国今年将实现“神州号”宇宙飞船载人飞行。发射飞船的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引燃后的高温气体主要是CO2、H2O、N2、NO,这些气体均为无色,但在卫星发射现场看到火箭喷射出大量红烟,产生红烟的原因是:
A. 高温下N2遇空气生成NO2 B. NO遇空气生成NO2
C. CO2与NO反应生成NO2 D. NO与H2O反应生成NO2
24. 当氨和氧一起通过加热的铂丝网时,在导出的产物中不可能出现的物质是:
A. NO B. NH4NO3 C. N2 D. H2O
25. 将1摩氨气和2摩氧气混和,在800℃铂催化剂作用下充分反应,当恢复到常温常压时,所得的产物是:
A. 二氧化氮与氧气 B. 一氧化氮与二氧化氮
C. 硝酸与一氧化氮 D. 硝酸与水
26. 将1mol NH3和2mol O2混和,在800℃铂催化剂作用下充分反应,当恢复到常温常压时,所得的产物是H2O和:
A. NO B. NO2 C. HNO3 D. NO、HNO3
27. 把a升含(NH4)2SO4和NH4NO3的混和溶液分成两等份,一份加入b摩烧碱并加热,恰好将全部NH4+转变成NH3放出;另一份需含c摩BaCl2溶液恰能完全沉淀SO42-,则原溶液中NO3-的物质的的浓度是:
A. (2b-4c)/a摩/升 B. (b-2c)/a摩/升
C. (2b-c)/a摩/升 D. (b-4c)/a摩/升
28. 已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶各收集满NH3和HCl气体,实验后二个烧瓶溶液的关系是:
A. 溶质的物质的量浓度相同、溶质的质量分数不同
B. 溶质的质量分数相同,溶质的物质的量浓度不同
C. 溶质的物质的量浓度和溶质的质量分数都不同
D. 溶质的物质的量浓度和溶质的质量分数都相同
29. 下列物质中既能与强碱反应又能与强酸反应:
A. (NH4)2SO3 B. NaHSO4 C. (NH4)2SO4 D. Mg(OH)2
30. 在下列反应中表示NH3既有还原性又有碱性的反应是:
A. NH3+HNO3=NH4NO3
B. 8NH3+3Cl2![]() N2↑+6NH4Cl
N2↑+6NH4Cl
C. 4NH3+5O2![]() 4NO↑+6H2O D. 2NH3+3CuO
4NO↑+6H2O D. 2NH3+3CuO![]() 3Cu+N2↑+3H2O
3Cu+N2↑+3H2O
31. 有一种白色固体化合物X,当它与NaOH溶液共热时,放出气体可使湿润的酚酞试纸变红色,这种溶液用硝酸酸化后,再加入氯化钡溶液时,能生成沉淀,则X可能是:
A. (NH4)2SO3 B. (NH4)2SO4 C. (NH4)2CO3 D. (NH4)3PO4
32. 一固体混和物,可能有氯化钙、碳酸铵、烧碱、硫酸铵,将它溶解于水得到无色澄清溶液,无其它明显现象,向溶液中加入硝酸钡溶液,产生白色沉淀,再加入硝酸,沉淀部分消失,原混和物中肯定没有
A. CaCl2 B. (NH4)2SO4 C. NaOH D. (NH4)2CO3
33. 一固体混和物,可能有氯化钙、碳酸铵、烧碱、硫酸铵,将它溶解于水得到无色澄清溶液,无其它明显现象,向溶液中加入硝酸钡溶液,产生白色沉淀,再加入硝酸,沉淀部分消失,原混和物中肯定有:
A. CaCl2 和(NH4)2SO4 B. (NH4)2SO4 和(NH4)2CO3
C. NaOH和CaCl2 D. NaOH和(NH4)2SO4
34. 混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是:
A. 向CuSO4溶液中加入适量铁粉
B. 等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液
C. 等物质的量的NaHCO3与Na2O2固体
D. 在NaBr溶液中通入过量氯气
35. 氢化铵(NH4H)与氯化铵结构相似,又已知NH4H与水反应有氢气产生,下列叙述不正确的是:
A. NH4H的电子式是: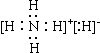
B. NH4H固体投入少量水中,有两种气体产生
C. NH4H中的H-离子半径比锂离子半径大
D. NH4H溶于水后,形成的溶液呈酸性
36. 把装满NO2气体的量筒倒置于水中,NO2除与水发生3NO2+H2O=2HNO3+NO↑反应外,尚有下列两个副反应:①2NO2+H2O=HNO3+HNO2;②NO2+NO+H2O=2HNO2。那么待反应完毕后,水位在量筒内上升的高度应是:
A. 高于量筒的2/3处 B. 为量筒的1/3处
C. 为量筒的2/3处 D. 低于量筒的1/3处
37. 亚硝酸钠有咸味,有毒,外观类似于食盐,故应严防把它误当作食盐用。区别亚硝酸钠与食盐的简便方法是:
A. 用甲基橙指示剂 B. 观察晶体的色态
C. 测试溶液的pH值 D. 品尝溶液的味道
[1] A
[1] C
[1] C
[1] B
[1] D
[1] C
[1] B
[1] A
[1] B、D
[1] B、D
[1] C
[1] B
[1] A、D
[1] A、C
[1] C
[1] C
[1] B
[1] D
[1] D
[1] B
[1] A
[1] D
[1] B
[1] C
[1] D
[1] C
[1] A
[1] A
[1] A
[1] B
[1] A、B
[1] C
[1] B
[1] B、D
[1] D
[1] A
[1] C