氮族元素练习题(四)
班级_______姓名________得分________
[i].填空
(1)久置的浓硝酸呈黄色,说明硝酸具有 性;
(2)打开浓硝酸瓶塞时有白雾生成,说明硝酸有 性;
(3)铝质或铁质容器可贮存冷的浓硝酸,说明硝酸有 性;
(4)王水是由 和 组成的混合物,其体积比为1︰3。
[ii].某混合气体中可能含有N2、O2、Cl2、HCl、NH3、NO、NO2中的两种或多种气体,现将此无色透明的混合气体通过浓硫酸后,气体体积明显减小,当剩余气体与空气接触时,立即变为红棕色,则原混合气体中一定含有的气体是 ,一定不存在的气体是 ,可能存在的气体是 。
[iii].在白炽灯的灯泡中加入极少量的红磷,其作用是什么?除此之外,还要充入一定量的氮气,其作用是什么?
[iv].亚硝酸盐对人体有毒,原因是它易使血液中的“高铁血红蛋白”含量增加;而维生素C能防止亚硝酸盐中毒,说明维生素C是一种较强的 。
[v].英国科学家瑞利用氯化铵与亚硝酸钠反应制得的“纯氮气”在标准状况下的密度为1.2506克/升;而自空气中提取的“纯氮气”在标准状况下的密度为1.2570克/升,二者相差0.0064克/升。他百思不得其解,在1892年9月《自然》杂志上公开求答,后来导致重大发现。请回答:为什么两者有如此的差异?并估计后来导致什么重大发现?
[vi].在一较浓的盐酸中加入一块铜片,即使加热也不发生反应;现在上述溶液中加入某种钠盐,不需要加热就可发现铜片参加反应,并最终得到蓝色透明的溶液,且有气体生成,请解释上述现象。
[vii].取氯化铵、消石灰(过量)混合物14g,混合均匀后加热,使其充分反应,发生反应的化学方程式为
,应选用
法收集气体。若要知道气体是否收满通常用
,证明已经收满;也可以用一根玻璃棒蘸取
,靠近收集气体的试管口,若有大量
生成,同样表示气体已收满。在收集气体时,试管口常常塞一团棉花,其作用是
。如果要干燥这种气体,一般选用的干燥剂是
,不能选用
、五氧化二磷和无水氯化钙等作它的干燥剂。假如上述方法在标准状况下收集到2.24L气体,则发生反应的氯化铵
g。
[viii].一支干燥的小试管中,装有少量的白色物质(约占试管容量的1/10),已知该白色物质是碳酸铵、碳酸氢钠、碳酸钠和氯化铵中的一种,现只通过加热试管中的固体进行鉴定。
(1)写出使用酒精灯给试管中(试管的夹持不必回答)固体加热的操作要点
(2)填写下表:
| 白色物质 | 判断依据的现象 | 有关化学方程式(无化学变化可不写) |
| 碳酸铵 | ||
| 碳酸氢钠 | ||
| 碳酸钠 | ||
| 氯化铵 |
[ix].如下图所示的实验装置
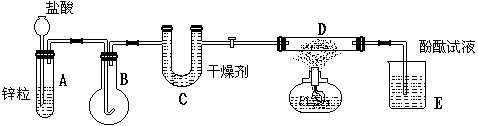
示意图中A是简易的氢气发生器,B是大小适宜的圆底烧瓶,C是装有干燥剂的U型管,D是装有还原铁粉的反应管,E是装有酚酞试液的烧杯。
实验前先检查实验装置的气密性,实验开始时,先关闭旋转活塞,并取下烧瓶B,向A中加入一定量浓度适当的盐酸,发生氢气。经必要的操作[见问题(2)]后,在导管的出口处点燃氢气,然后如图所示套上烧瓶B,塞紧瓶塞,氢气在烧瓶中继续燃烧。用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞,气体通过反应管D进入试管E中,使酚酞溶液呈红色。请回答下列问题:
(1)实验前如何检查装置的气密性?
(2)点燃氢气前必须进行 操作,进行该操作的方法是 。
(3)写出B、D中分别发生反应的化学方程式。
[x].下图中A是H2发生器,B是大小适宜的圆底烧瓶,C是装有干燥剂的U形管,D是装有还原铁粉的反应管。实验前先检查实验装置 的气密性。实验开始时,先关闭活塞W,并取下烧瓶B;向A中加入一定量浓度的盐酸适量,产生H2。经必要的操作后,在导管的出口处点燃氢气,然后如图所示套上烧瓶,塞紧瓶塞,氢气在烧瓶中继续燃烧。用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞W,B瓶中的气体通过U形管后在D中反应,进入E,最后进入F中(F中装有某种物质的溶液,作检验之用)。
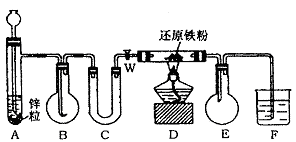
请回答下列问题:
(1)实验前如何检查装置气密性?
(2)点燃H2前必须进行什么操作?为什么?
(3)写出B、D中分别发生反应的化学方程式。
B中 。
D中 。
(4)U形管中,应盛试剂是 ,其作用是 。
(5)E装置作用是 。
(6)F中可装 的溶液,发生的现象为 。
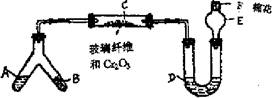 [xi].微型化学实验具有装置小巧,节约药品,操作简便,现象明显,安全可靠,减少污染等特点。右图是某同学设计的NH3催化氧化并检验反应生成的酸性物质的微型装置(图中必要的铁架台、铁夹、微型酒精灯等均已略去)。已知:NO2+NO+2NaOH=2NaNO2+H2O
[xi].微型化学实验具有装置小巧,节约药品,操作简便,现象明显,安全可靠,减少污染等特点。右图是某同学设计的NH3催化氧化并检验反应生成的酸性物质的微型装置(图中必要的铁架台、铁夹、微型酒精灯等均已略去)。已知:NO2+NO+2NaOH=2NaNO2+H2O
实验中所用的试剂不超出下例范围:
①NH4Cl和Ca(OH)2的混合物;②4∶1氨水;③NaOH固体;④KClO3和MnO2的混合物;⑤蒸馏水;⑥NH4HCO3固体;⑦6mol·L-1NaOH溶液;⑧0.5mol·L-1 NaOH溶液;⑨酚酞试液;⑩碱石灰;⑾浓H2SO4;⑿CuO。
试回答下列问题:
(1)微型叉形管中液态物质A是 ,固体物质B是 ;
(2)C处发生反应的化学方程式是 ;
(3)混合物D是为了检验酸性物质的生成而放入的,其组成是 ,实验过程中的现象是 ;
(4)E处球形玻璃管的作用是 ;
(5)F处的棉花应蘸取的物质是 ,其作用是 。
[xii].干燥的氨气在高温下能被氧化铜氧化,生成两种单质和一种化合物。完成上述反应可选用下列装置进行。

(1)当气体流向从左到右时,仪器连接的顺序是_______________。
(2)装置B的作用是_______________。装置C的作用是_______________。
(3)装置D中反应的化学方程式是_______________。
[xiii].氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去)。回答下列问题。
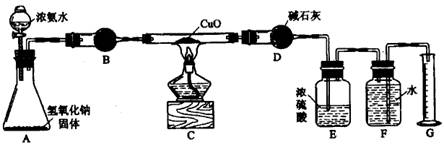
(1)写出氨气与氧化铜反应的化学方程式 。
(2)在A的锥形瓶中放入NaOH固体的目的是 。
(3)在干燥管B里不能选用的干燥剂是(填序号) 。
A 碱石灰 B 生右灰 C 五氧化二磷 D 氢氧化纳
(4)在C的玻管中观察到的现象是 。
(5)E装置中盛装浓硫酸的目的是 。
(6)待实验完毕后,若实验测得N2的体积(折算成标准状况)为止,则被还原的氧化铜的物质的量为 mol;若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。
(7)上述实验中,如果省去B装置,测定氨分子组成的N、H原子个数的比值将会(填“增大”、“减少”或“无影响”) ,理由是 。
[i] (1)不稳定性 (2)挥发性 (3)强氧化性 (4)浓盐酸 浓硝酸(8分)
[ii] NH3、NO Cl2、NO2、HCl、O2 N2(7分)
[iii] (1)除去灯泡内残留的氧气,延长灯泡的使用寿命 (2)使灯泡内保持一定的压强,并阻止钨丝的氧化和挥发,使灯泡经久耐用
[iv] 还原剂
[v] 由化学药品制得的氮气相对较纯净:NH4Cl+NaNO2=N2↑+NaCl+2H2O,其标准状况下的密度为1.2506克/升。而由空气除去氧气等其它杂质后,剩余的气体除氮气外还有当时还未发现的稀有气体,主要是氩气,它虽为单原子分子,但分子量为40,比氮气的分子量大,它约占空气的1%,正因为由它的存在,就使得由空气制得的“纯氮气”实际上存在着一定量的氩气,其密度比纯净的氮气大也就毫不奇怪了,由此导致后来氩元素的发现。
[vi] 加入的钠盐是硝酸钠,因硝酸根在酸性条件下具有强氧化性,使之发生如下的反应:8H++2NO3-+3Cu=3Cu2++2NO↑+4H2O
[vii] 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑十2H2O(2分) 向下排空气集气(1分) 湿润的红色石获试纸放在收集氨气的试管口,若试纸变蓝(2分) 浓盐酸(1分) 白烟(1分) 防止与空气对流,氨气大量逸出污染大气,缩短集气时间,提高氨气的纯度(2分) 碱石灰(1分) 浓硫酸(1分) 5.35g(2分)
CaCl2+2NH3↑十2H2O(2分) 向下排空气集气(1分) 湿润的红色石获试纸放在收集氨气的试管口,若试纸变蓝(2分) 浓盐酸(1分) 白烟(1分) 防止与空气对流,氨气大量逸出污染大气,缩短集气时间,提高氨气的纯度(2分) 碱石灰(1分) 浓硫酸(1分) 5.35g(2分)
[viii] (1)试管口略微向下倾斜,开始用外焰在试管底部来回移动均匀加热,然后用外焰在盛固体部位集中加热。(2)
| 白色物质 | 判断依据的现象 | 有关化学方程式(无化学变化可不写) |
| 碳酸铵 | 试管中没有残留固体,试管内壁有水珠 | (NH4)2CO32NH3↑+ H2O↑+CO2↑ |
| 碳酸氢钠 | 试管中有白色固体残留,试管内壁有水珠 | 2NaHCO3Na2CO3 + H2O↑+ CO2↑ |
| 碳酸钠 | 试管中有白色固体残留,试管内壁无水珠 | ------------------------------ |
| 氯化铵 | 固体全部由试管底部转移到试管上部内壁 | NH4ClNH3↑ + HCl↑ |
[ix] (1)打开活塞,给A中加水把长颈漏斗下端封住,再微热烧瓶B,如果既能发现E中有气泡冒出,A中漏斗颈内水面上升,则可说明整个装置气密性良好 (2)检验氢气的纯度 略 (3)2H2+O2=2H2O N2+3H2=2NH3
[x] (1)关闭W,用手握住E瓶,或微热D管,若F中导气管处有气泡排出,松开手或停止加热,导气管中有一段水柱上升,证明W→F气密性好。 在A中,从长颈漏斗处加水至浸没长颈漏斗下口端(液封),再关闭W,用手握住烧瓶B(或微热B),若A中水沿长颈部分上升一段水柱,松手或停止加热后,水柱回落,证明A→W部分气密性好。 (2)用一小试管集满H2后,移近火焰,若听到尖锐的爆鸣声,证明气体不纯;若只听到轻微“噗”的声响,证明H2纯净。 (3)B中:2H2+O2=2H2O D中:N2+3H2![]() 2NH3 (4)碱石灰;除去HCl和水蒸气 (5)防止水倒吸进入D中加热的试管中,兼收集NH3的作用 (6)酚酞溶液;溶液由无色变成红色
2NH3 (4)碱石灰;除去HCl和水蒸气 (5)防止水倒吸进入D中加热的试管中,兼收集NH3的作用 (6)酚酞溶液;溶液由无色变成红色
[xi] 4︰1氨水(或②) KClO3和MnO2的混合物(或④) (2)4NH3+5O2![]() 4NO+6H2O (3)0.5mol/L NaOH溶液和酚酞试液(或⑧、⑨) 红色褪去 (4)安全(或防止液态物质冲出) (5)6mol/LNaOH溶液(或⑦) 吸收氮的氧化物
4NO+6H2O (3)0.5mol/L NaOH溶液和酚酞试液(或⑧、⑨) 红色褪去 (4)安全(或防止液态物质冲出) (5)6mol/LNaOH溶液(或⑦) 吸收氮的氧化物
[xii] (1)A、C、D、B;(2)吸收多余的氨气 干燥氨气;(3)2NH3+3CuO3Cu+N2+3H2O
[xiii] (1)2NH3+3CuO![]() N2+3Cu+3H2O (2)NaOH的强碱性及溶解产生的热利于氨气的逸出。 (3)C (4)黑色粉末变为光亮的红色固体。 (5)将反应剩余的氨吸收。 (6)3a/22.4 9a/11.2b (7)减小,D装置吸收的水中包含了从A中带出的水份。
N2+3Cu+3H2O (2)NaOH的强碱性及溶解产生的热利于氨气的逸出。 (3)C (4)黑色粉末变为光亮的红色固体。 (5)将反应剩余的氨吸收。 (6)3a/22.4 9a/11.2b (7)减小,D装置吸收的水中包含了从A中带出的水份。