氮族元素练习题(三)
班级_______姓名________得分________
1. 各取0.1mol铜分别投入足重的下列四种酸中(必要时可加热):
①浓硫酸;②浓硝酸;③稀硫酸;④稀硝酸
充分反应后,在相同条件下得到的气体体积由大到小的顺序是:
A. ②④①③ B. ②①④③ C. ①②④③ D. ③④①②
2. 铜与1mol/L的硝酸反应,若NO3-浓度下降了0.2mol/L,则溶液中c(H+)同时下降:
A. 0.2mol/L B. 0.4mol/L C. 0.6rnol/L D. 0.8mol/L
3. 下列物质在加热条件下被碳还原,氧化产物与还原产物的价态不同的是:
A. CuO B. 浓硫酸 C. 浓硝酸 D. CO2
4. 烧瓶中放入铜片和稀硝酸,用酒精灯加热来制取较纯净的一氧化氮,反应开始后发现烧瓶中充满棕红色气体,这时的操作应是:
A. 立即接上收集容器,用向上排空气法收集
B. 待烧瓶中红棕色消失后,用向上排空气法收集
C. 待烧瓶中红棕色气体消失后,用排水法收集
D. 立即用排水法收集
5. 下列各组物质均在试管里进行反应,反应过程中,在试管口观察不到红棕色气体出现的是:
A. 浓硝酸和铜片共热 B. 浓硫酸和铜片共热
C. 稀硝酸和铜片共热 D. 浓硫酸和硝酸钾晶体、铜片共热
6. 常温下,将等物质的量的铜片、铁片、铝片、银片分别置于4个小烧杯中,然后各加入足量的浓硝酸,放出NO2气体的体积最多的是:
A. 铜片 B. 铁片 C. 银片 D. 铝片
7. 铜既不溶于稀硫酸,也不溶于KNO3溶液,现有2mol/L稀硫酸15mL,往其中加入2.02g KNO3晶体,充分溶解,该混和液最多可溶解铜的物质的量为:
A. 0mol B. 0.0075mol C. 0.03mol D. 0.0225mol
8. 某金属单质跟一定浓度的硝酸发生反应,假定只有单一的还原产物,当参加反应的单质与被还原的硝酸的物质的量之比是2︰1,还原产物是:
A. NO2 B. NO C. N2O D. N2
9. 某单质跟浓硝酸反应,若参加反应的单质与硝酸的物质的量之比为1︰4,则该元素在反应中所显示的化合价可能是:
A. +1 B. +2 C. +3 D. +4
10. 一定量的浓硝酸与足量的铜反应(后期加热),得到对氢气的相对密度为28的混和气体,该气体通过水后,体积缩小了1/3,则混和气体中含NO2的体积百分含量为:
A. 85.5% B. 66.7% C. 33.3% D. 27.4%
11. 14克铜、银合金与足量的某浓度的硝酸反应,将放出气体与1.12升(标况)氧气混合,通入水中恰好全部吸收,则合金中铜的质量是:
A. 9.6克 B. 6.4克 C. 3.2克 D. 1.6克
12. 下列各组混和物中,若将它放入水中能产生白色沉淀,加入足量稀硝酸后沉淀溶解并产生气体,再加入硝酸银溶液又产生白色沉淀的是
A. Na2CO3、Al(OH)3 B. K3PO4、CaCl2
C. MgCl2、K2CO3 D. Na2SO4、Ba(OH)2
13. 用0.25摩/升磷酸中和25毫升0.3摩/升的Ca(OH)2溶液,只生成正盐,则需物体积是:
A. 8.3毫升 B. 20毫升 C. 30毫升 D. 75毫升
14. 某学生用加热的办法测定磷酸二氢钙结晶水合物中的结晶水,称出a克结晶水合物置于坩埚中加热,但加絷时由于温度控制不适当而偏高,导致磷酸二氢钙分解,结果得到b克无水偏磷酸钙,该学生经过一番思考后,没有重新做实验,就算出了结晶水的分子数,而且得到了老师的肯定,该结晶水分子数n的正确计算式为:
A. (a-b)/18 B. (11a-13b)/b
C. (119a-234b)/18b D. (119a-137b)/18b
15. 要除去某硝酸钾溶液中含有的少量溴化钾、磷酸二氢钙杂质,依次进行如下的操作:
(i)加入稍过量的氢氧化钾溶液 (ii)加入稍过量的硝酸银溶液
(iii)加入稍过量的碳酸钾溶液 (iv)过滤
(v)用稀硝酸调节pH=7,其中操作(ii)中所发生的反应是:
①Ag++Br-=AgBr↓ ②3Ag++PO43-=Ag3(PO4)3↓ ③Ag++OH-=AgOH↓
④2Ag++HPO42-=Ag2HPO4↓ ⑤Ag++H2PO4-=AgH2PO4
A. ①② B. ①②③ C. ①②③④ D. ①②③④⑤
16. 2001年1月,某地发生了导致四人死亡、一百多人中毒的食用熟牛肉中毒事件,经过对该牛肉的检测,发现某盐的含量比国家允许标准高800多倍,该盐可能是:
A. NaCl B. NaNO2 C. NaNO3 D. BaSO4
17. 据医学报道,常吃盐腌菜者比不吃者得胃癌的相对危险性高5~6倍,这是因为腌菜发酵时:
A. 硝酸盐被还原为亚硝酸盐 B. 蛋白质被分解转化为亚硝酸胺类
C. 纤维素被水解为葡萄糖 D. Na+和Cl-离子的浓度大大增加
18. 第二次世界大战期间,某国有支侦查小分队到德国法西斯一座十分隐蔽且又戒备森严的军火厂。上级要求小分队在三天内必须炸毁它,结果他们用十多只涂有化学药剂的老鼠完成了任务。据你推测这种化学药剂是
A. TNT B. KMnO4和H2SO4 C. 黑火药和甘油 D. 白磷的CS2溶液
19. 31克白磷分子中存在的共价键数目是(NA为阿佛加德罗常数):
 A. 4NA
B. NA C. 1.5NA
D. 0.25NA
A. 4NA
B. NA C. 1.5NA
D. 0.25NA
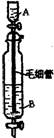
20. Inorganic Syntheses一书中,有一如右图所示装置,用以制备某种干燥的纯净气体。该装置中所装的药品正确的是:
A. A中装浓硫酸,B中装浓盐酸
B. A中装浓盐酸,B中装浓硫酸
C. A中装氢氧化钠浓溶液,B中装浓氨水
D. A中装浓氟水,B中装氢氧化钠浓溶液
21. NCl3是一种淡黄色的油状液体,其分子具有三角锥形结构,下列对NCl3的有关描述正确的是:
A. 它是一种非极性分子
B. 具有比PCl3更大的挥发性
C. 它还能以配位键跟Cl-结合
D. 已知NBr3对光很敏感,故NCl3不具光敏性
22. 三氟化氮(NF3)是一种无色无味的气体,它是氨(NH3)和氟(F2)在一定条件下直接反应得到: 4NH3+3F2=NF3+3NH4F,下列有关NF3的叙述正确的是:
A. NF3是离子化合物 B. NF3的还原性比NH3强
C. NF3的氧化性比F2强 D. NF3中的N呈+3价
23. NCl3的电子式为![]() ,则NCl3与H2O反应时,最初的生成物一定有:
,则NCl3与H2O反应时,最初的生成物一定有:
A. NH3 B. HNO2 C. HClO D. NH4Cl
23. 1999年曾报道合成和分离了含高能量的正离子N5+化合物N5AsF6,下列叙述错误的是:
A. N5+共有34个核外电子
B. N5+中氮—氮原子间以共用电子对结合
C. 化合物N5AsF6中As化合价为+1
D. 化合物N5AsF6中F化合价为-1
24. 当将金属钠溶解在液氨中时,能形成一种兰色的液氨溶液,兰色据认为是生成了电子氨化物e(NH3)n-的缘故,其生成可用以下的反应式表示:Na+nNH3=Na++e(NH3)n-,小心蒸去氨气可得白色固体NaNH2,而且有以下反应发生:2Na+2NH3=2NaNH2+H2↑,下列说法不正确的是:
A. 液氨不能发生电离 B. 液氨能电离出NH4+和NH2-
C. 钠的液氨溶液是强的还原剂 D. 蒸发钠的液氨溶液时兰色会逐渐褪去
25. 已知联氨(H2N-NH2)与NH3的性质相似,如:
4NH3+3O2(纯)![]() 2N2+6H2O N2H4+O2(空气)
2N2+6H2O N2H4+O2(空气)![]() N2+2H2O
N2+2H2O
关于N2H4性质叙述中错误的是:
A. 溶于水溶液呈碱性 B. 沸点比NH3高
C. 还原性比NH3强 D. 1mol N2H4可与2mol HCl反应
![]() 26. 如右图所示,两个连通容器用活塞分开,左右两室各充入一定量NO和O2,且恰好使两容器内气体密度相同,打开活塞,使NO与O2充分反应,最终容器内混合气体密度比原来:
26. 如右图所示,两个连通容器用活塞分开,左右两室各充入一定量NO和O2,且恰好使两容器内气体密度相同,打开活塞,使NO与O2充分反应,最终容器内混合气体密度比原来:
A. 增大 B. 减小 C. 不变 D. 无法确定
27. NaNO2大量进入血液时,能将血红蛋白中的Fe2+氧化成Fe3+,正常的血红蛋白转化为高价铁血红蛋白,失去携氧功能,引起中毒,甚至死亡。下列各组试剂不能检验食盐中是否含有NaNO2的是:
A. FeCl2 KSCN B. KMnO4 H2SO4
C. AgNO3 HNO3 D. KI 淀粉
28. 检验NO3-的方法是:在试液中加入饱和FeSO4溶液摇匀,将试管倾斜成45°左右,沿管壁缓慢加入硫酸,静置片刻,在两液体的界面上有棕色环产生,这种棕色环的主要成份是:
A. Fe(SO4)3 B. Fe(NO)SO4 C. Fe(NO2)SO4 D. Fe(OH)SO4
29. Fe(NO3)2加热分解反应为Fe(NO3)2-Fe2O3+NO2↑+O2↑(未配平),将Fe(NO3)2与AgNO3的混合物加热后,放出的气体通过排水法收集时得不到气体,由此可知混合物中Fe(NO3)2与AgNO3物质的量之比为:
A. 1︰1 B. 2︰1 C. 1︰2 D. 无法计算
30. 电视剧《西游记》中仙境美仑美奂。这些神话仙境中所需的烟幕是用NH4NO3和Zn粉按质量比8︰6.5混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟,又知发生反应后有N2和水生成。有关的说法中正确的是:
A. 水起着溶解NH4NO3,发生吸热现象以启动反应的作用
B. 每还原1mol NO3- 需氧化1mol Zn和1mol NH4+
C. 成烟物质是两性氧化物小颗粒
D. 成烟物质是小锌粒,它由NH4NO3反应放热而蒸出
31. 有化学实验能证明,安全火柴在摩擦起火的过程中,发生化学变化的可能是下列两种物质之间:
A. 氯酸钾与二氧化锰 B. 氯酸钾与白磷
C. 氯酸钾与红磷 D. 二氧化锰与三硫化锑
32. 将白磷隔绝空气加热到260℃可转变为红磷。以下说法正确的是:
A. 白磷转变为红磷是一个吸热过程
B. 红磷比白磷稳定
C. 白磷转变为红磷需外界提供引发反应的能量
D. 白磷比红磷稳定
33. 白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体——黑磷,其转化过程如下:白磷![]() 黑磷,黑磷性质稳定,结构与石墨相似。下列叙述正确的是:
黑磷,黑磷性质稳定,结构与石墨相似。下列叙述正确的是:
A. 黑磷与白磷互为同分异构体 B. 黑磷能导电
C. 白磷转化为黑磷是物理变化 D. 黑磷能在空气中自燃
34. As2S3和As2O3的性质相似,均有还原性;Na2S2和Na2O2的性质相似,均有氧化性,当As2S3与Na2S2相互反应时,生成的盐是:
A. Na3AsS4 B. Na2AsS3 C. Na3AsS3 D. Na2AsS4
35. 对于反应:As2S3+3S22-=2AsS43-+S的正确说法是:
A. 属于置换反应 B. S22-只是还原剂
C. As2S3是还原剂 D. AsS43-既是氧化产物又是还原产物
36. 液氨溶解碱金属后成为蓝色的导电能力很强的溶液,其颜色被认为是电子的氨合物[e(NH3)n-]引起的,若放置蓝色逐渐褪去,蒸发褪色后的溶液可以得到白色的氨基钠(NaNH2),反应为:2Na+2NH3=2NaNH2+H2,据此有关说法不正确的是:
A. 溶液褪色速率与逸出氢气的速率相对应
B. 液氨中有电离过程:2NH3=NH4++NH2-
C. 碱金属的液氨溶液是强还原剂
D. 液氨是一种非电解质,在水中才能电离
[1] B
[1] D
[1] A
[1] C
[1] B
[1] A
[1] D
[1] C
[1] B、D
[1] C
[1] C
[1] B
[1] D
[1] A
[1] C
[1] B
[1] A
[1] D
[1] C
[1] B、D
[1] C
[1] C
[1] C
[1] B
[1] B
[1] B
[1] B
[1] A
[1] D
[1] C
[1] B
[1] B
[1] D
[1] A、C
[1] C
[1] A
[1] C
[1] C
[1] B、C
[1] B
[1] A