《几种重要的金属》复习
有关铁的知识
一、常见铁的化合物:
Fe2O3 红棕色粉末 FeSO4 白色固体
Fe3O4 黑色晶体 FeSO4·7H2O 浅绿色晶体,
FeO 黑色粉末 FeCl3 棕黑色
Fe(OH)2 白色固体 FeCl3·6H2O 棕黄色
Fe(OH)3 红褐色固体
二、Fe3+与Fe2+的转变:
2FeCl2 + Cl2 = 2FeCl3
6FeCl2 + 3Br2 = 4FeCl3 + 2FeBr3
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
2FeCl3 + Cu = CuCl2 + 2FeCl2 (在酸性环境下)
2FeCl3 + Fe = 3FeCl2 (在酸性环境下)
2FeCl3 + H2S = 2FeCl2 + 2HCl + S↓
三、Fe3+与Fe2+的鉴别:
1、观察法:其溶液呈棕黄色者是Fe3+,呈浅绿色者是Fe2+
2、H2S法:通入H2S气体或加入氢硫酸,有浅黄色沉淀析出者是Fe3+,无明显变化的是Fe2+。
3、KSCN法:加入或其它可溶性硫氰化物溶液,呈血红色者是Fe3+,无明显变化的是Fe2+。Fe3++ SCN- = [Fe(SCN)]2+
4、碱液法:分别通入氨气或加入氨水或碱液,生成红褐色沉淀者是Fe3+,生成白色沉淀,并变为灰绿色,最终变成红褐色者是Fe2+。
5、淀粉KI试纸法:能使淀粉KI试纸变蓝者Fe3+,无明显变化的是Fe2+。
2Fe3+ + 2I- = 2Fe2+ + I2
6、铜片法:分别加入铜片,铜片溶解且溶液变为蓝色者是Fe3+,无明显变化的是Fe2+。 Fe3+ + Cu = 2Fe2+ + Cu2+
7、KMnO4法:分别加入少量酸性KMnO4溶液,能使KMnO4溶液的紫红色变浅的是Fe3+,颜色基本无变化的是Fe2+。
5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ +4H2O
原电池
一、原电池:将化学能(化学反应中失放的能量)转变为电能的装置。
原电池的形成条件:
(1).要有两根活泼性(金属性)不同的电极。
(2).要有电解质溶液,且电解质溶液至少应和活泼电极发生反应。
(3).两根电极应用导线相连或相互接触。
上述三个条件缺少一个都不能形成原电池。
二、原电池的电极反应:
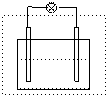 1.原电池的电极: 在原电池中,金属性强(还原性强)的电极失去电子,电子经过外电路流向金属性弱(还原性弱)的电极,电解质的离子在金属性弱的电极上获得电子,因此电子的流向是由活泼电极流向不活泼电极。电流的方向和电子的流向相反,是由不活泼电极流向活泼电极的。我们把电流流出(电子流入)的电极称作原电池的正极,把电流流入(电子流流出)的电极称作原电池的负极。负极失去电子,被氧化(发生氧化反应),一般情况下电极将被慢慢溶解
1.原电池的电极: 在原电池中,金属性强(还原性强)的电极失去电子,电子经过外电路流向金属性弱(还原性弱)的电极,电解质的离子在金属性弱的电极上获得电子,因此电子的流向是由活泼电极流向不活泼电极。电流的方向和电子的流向相反,是由不活泼电极流向活泼电极的。我们把电流流出(电子流入)的电极称作原电池的正极,把电流流入(电子流流出)的电极称作原电池的负极。负极失去电子,被氧化(发生氧化反应),一般情况下电极将被慢慢溶解![]()
![]() (也称腐蚀);在正极,电解质的离子获得电子,被还原(发生还原反应),一般有物质析出(析出金属或放出气体),正极本身没有参加反应(被保护)。
(也称腐蚀);在正极,电解质的离子获得电子,被还原(发生还原反应),一般有物质析出(析出金属或放出气体),正极本身没有参加反应(被保护)。
(1).负极(活泼电极):失去电子,被氧化,电极被溶解。 - Zn Cu +
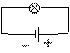 (2).正极(惰性电极):得到电子,被还原,电极被保护。
(2).正极(惰性电极):得到电子,被还原,电极被保护。
以铜锌原电池为例说明如下:
稀CuSO4
负极:锌较活泼作负极,锌失去电子被氧化,锌慢慢溶解,电子由锌极流出,电流由锌极流入。
正极:铜不活泼作正极,铜离子得到电子,铜电极上有铜析出,电子由铜极流入,电流由铜极流出。
2.电极反应式:
在上述原电池中,负极上锌失去电子,用电极反应式表示为Zn-2e=Zn2+正极上铜离子得到电子,用电极反应式表示为Cu2++2e=Cu。
练习
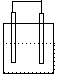
1.在下列各装置中,溶液质量增大的是
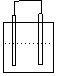
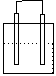
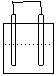 Cu Zn Cu Ag
Fe C
Fe Zn
Cu Zn Cu Ag
Fe C
Fe Zn
稀H2SO4 稀AgNO3 稀H2SO4 稀AgNO3
A B C D
2.下列各装置中接入的灯泡的功率相同,则灯泡最亮的是
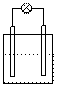

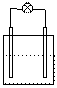
 Zn C Fe C
Sn C Cu C
Zn C Fe C
Sn C Cu C
0.1mol/LAgNO3 0.1mol/LAgNO3 0.1mol/LAgNO3 0.1mol/LAgNO3
A B C D
3.把a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连,可组成原电池。a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极,则其金属活动性
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
电化学腐蚀:
1.析氢腐蚀:
空气中有大量的CO2腐蚀:气体(也含有其它的酸性气体),CO2溶于水后将使溶液表现出酸性,如果在酸性较强的环境中,就构成了Fe、C、含H+的电解质溶液的原电池,电极反应式如下:
负极(Fe): Fe - 2e- = Fe2+ 正极(C) : 2H+ + 2e-= H2↑
由电极反应式可知,铁作负极被溶解,碳作正极有H2放出,反应过程中将消耗H+。因为有H2放出,所以将这种环境中发生的钢铁腐蚀叫析氢腐蚀。
2.吸氧腐蚀:
通常情况下,酸性较强的水溶液环境是不多见的,我们所见的水溶液一般都是弱酸性、中性或弱碱性的,因此析氢腐蚀并不普遍。在弱酸性、中性或弱碱性的环境中是不是钢铁就不发生腐蚀呢?事实并非如此。因为水溶液中溶解有一定量的氧气,而氧气是一种强的氧化剂,具有较强的得电子能力,在这样的环境中氧气将在碳极上得到电子,使钢铁腐蚀仍然发生。电极反应式如下:
负极(Fe): Fe-2e-= Fe2+
正极(C) : O2+2H2O+4e-=4OH-
由电极反应式可知,在这种环境中,铁仍然作负极被溶解,但碳作负极吸收了氧气,反应过程中生成了OH-。因为吸收了氧气,因此这些环境中的腐蚀叫吸氧气腐蚀。
注意:
铝和强碱溶液反应,不是铝直接和碱反应,而是铝先和强碱溶液中的水反应生成Al(OH)3,然后Al(OH)3再和强碱反应生成偏铝酸盐。
2Al+6H2O==2Al(OH)3+3H2↑ NaOH+Al(OH)3==NaAlO2+2H2O
6e-
2Al+6H2O+2NaOH==2NaAlO2+4H2O+3H2↑
上式可简写为:2Al+2H2O+2NaOH==2NaAlO2+3H2↑
巩固练习
1.铝和镁比较,铝的硬度较大,熔点和沸点较高.这是因为
A 镁的核电荷数较大,原子量较大
B 镁离子和自由电子的作用力较弱
C 铝离子所带的正电荷比镁离子的多
D 铝的原子半径较大
2.能说明镁比铝还原性强的事实是:
A Mg的价电子比铝少
B 镁带在空气中和CO2中能燃烧,而铝不能
C Mg遇浓硫酸不钝化,而铝钝化
D 铝的硬度、延展性、熔点均比镁大、好、高
3.铁片投入下列溶液后,金属片质量减少,但无气体放出的是:
A 冷、浓HNO3 B Cu(NO3)2 溶液 C 稀HNO3 D Fe(NO3)3溶液
4.下列离子方程式正确的是:
A. FeBr2 溶液中加入过量氯水: 2Fe2+ +Cl2 = 2Fe3++2Cl-
B. 铁粉和FeCl3 溶液反应: Fe + Fe3+ = 2Fe2+
C. 铁粉和过量的稀HNO3 反应: Fe+NO3-+4H+ = Fe3+ +NO ↑+2H2O
D. Mg(HCO3)2 溶液 与过量 NaOH 溶液反应:
Mg2++2HCO3-+2OH- = MgCO3 ↓ + CO32-+2H2O
5.有甲、乙、丙、丁四种金属,将甲、乙用导线相连放人稀硫酸中可以看到乙慢慢溶解,而甲的表面有气泡逸出;把丁放到乙的硝酸盐溶液中后,丁表面覆盖一层乙的单质;用石墨电极电解含有相同物质的量浓度的甲和丙两种金属的盐溶液,丙的单质先析出;将甲放入稀盐酸中有H2析出,已知四种金属中有一种是铜,根据以上实验判断铜是
A 甲 B 乙 C 丙 D 丁
6.Cu+在酸性溶液中可发生自身氧化-还原反应生成Cu2+和单质铜,若要检验用氢气还原氧化铜所得的红色产物中是否含有Cu2O,应选用的试剂和相对应的实验现象正确的是
A 浓H2SO4,是否有无色气体生成 B 稀HNO3,是否生成蓝色溶液
C 稀H2SO4,固体物质是否溶解 D 稀HCl,是否生成蓝色溶液
7. 一定量的Fe 和Fe2O3 混合物投入250 ml 2 mol/L 的 HNO3 溶液中, 反应完全后, 无固体剩余, 生成1.12L NO气体 (标况), 再向反应后溶液中加入1 mol/L 的 NaOH 溶液, 要使铁元素全部沉淀下来, 所加NaOH 溶液的体积最少的是
A. 450ml B. 500 ml C. 400 ml D. 无法确定
8.向明矾溶液中滴入Ba(OH)2溶液,当SO42-恰好沉淀完全时,这时铝元素较大量的存在形式是
A Al(OH)3和Al3+ B Al(OH)3和AlO2- C Al(OH)3 D AlO2-
9.下列各组离子在溶液中不能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是
A Fe3+、CI-、Na+、SO42- B AI3+、Na+、CO32-、NO3-
C Ag+、Na+、SO42-、NO3- D AIO2-、CO32-、K+、Na+
10.碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜,在高温下这两种化合物均能分解生成氧化铜,溶解28.4g上述混合物,消耗1mol·L-1盐酸500mL,灼烧等量的上述混合物,得到氧化铜的质量是
A 35g B 30g C 20g D 15g
11.有MgCl2、Al2(SO4)3的混合溶液,向其
中不断加入NaOH溶液,得到的沉淀量与加
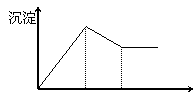 入的NaOH溶液的关系如图所示,则溶液中
入的NaOH溶液的关系如图所示,则溶液中
|
A 1∶1 B 2∶3
C 3∶2 D 2∶1
12.有人设计了Pt和Zn为电极材料的电池埋入人体内作为某种心脏病人的心脏起搏器的能源,它依靠人体体液中含有一定浓度的溶解氧、H+和Zn2+进行工作。下列说法中正确的是
A Pt作负极
B 正极发生的电极反应为:O2+2H2O+4e-=4OH-
C 负极发生的电极反应为:O2+2H2O+4e-=4OH-
D 正极发生的电极反应为:2H++2e-=H2↑
13.按要求回答下列问题:
(1)长期加热煮沸暂时硬水所形成的水垢的主要成分是 。
(2)钢铁在潮湿的空气中生锈,有关的电极反应方程式为:
负极: ,正极: 。
(3)冶金工业上用金属铝和V2O5制取金属钒的化学方程式为 。
(4)只用一种试剂可以把Fe、FeO、FeS、CuO、C、MnO2六种黑色粉末鉴别出来,该试剂是 。
(5)实验室配制硫酸亚铁溶液时,先将其晶体溶于稀硫酸中,其原因是 。
14.实验室分析白铁(镀锌的铁)样品成分,称取1.00g样品放在烧杯中,加入过量盐酸,然后用玻璃片盖住烧杯,首先观察到大量气体冒出,后来放出气体速率变慢,最后完全反应。接着加入过量的NaOH溶液,过滤分离出灰绿色沉淀,该沉淀在空气中加热至质量不变,最后得到1.20g红色粉末。
(1)白铁镀锌的作用是________ _;盖玻璃片的作用是_______ _______。
(2)放出气体速率由快变慢的原因是____ __________。
(3)为什么要加入过量NaOH溶液_____ _________。
|
15.草酸晶体(H2C2O4)和浓硫酸混合缓慢加热时,可发生如下反应:H2C2O4= CO2+CO+H2O。某课外活动小组的学生设计了如下实验装置,用来制取干燥纯净的CO气体,并用生成的CO气体还原FexOy,制取铁粉。
 |
(1)装置B的作用是 。
装置E中的现象是 。
装置F的作用是 。
(3)装置D中玻璃管中发生反应的化学方程式为 ,
若FexOy为0.4g,生成的气体与过量澄清石灰水反应生成0.75g白色沉淀,则FexOy的化学式为 。
(4)在实验开始时,点燃A、D酒精灯的先后顺序是 ,实验完毕后,熄灭A、D酒精灯的先后顺序是 。
16.把一支表面被氧化成10.2g氧化铝的铝条A,放入1L1.5mol/L热氢氧化钠溶液中,过一段时间后取出铝条,溶液质量增加了12.6g,此时的溶液称为甲溶液,体积仍为1L。再把另一支表面也被氧化的一定量的铝条B,放入1L0.9mol/L硫酸溶液中,过一会儿取出,其质量减小了25.8g,溶液的质量增加了25.2g,此时的溶液称为乙溶液,体积仍为1L。回答下列问题:
(1)甲溶液的溶质是________________(写化学式),其物质的量__________________ 。
(2)乙溶液的溶质是_______________________(写化学式),其物质的量是__________。
(3)将甲、乙两溶液反应,若使滴加的量最少,而产生的沉淀最多,应将________溶液
______L滴加到_________溶液(用“甲”或“乙”填写),产生的沉淀最多是________g