《氮族元素》试卷
(时间:50分钟。满分100分)
2003.12.12
可能用到的相对原子质量: H: 1 O: 16 N: 14 Na: 23 Cl: 35.5 C: 12 Ca: 40 Cu:64
S: 32 Fe: 56 Mg: 24 P: 31 Zn:65 Ba:137
一、选择题(下列各题只有一个选项符合题意。每小题4分,共60分。请将答案填在答题卡上)
1. 在实验室中,下列实际的保存方法正确的是①白磷保存在冷水中②Na保存在CCl4中③HF溶液保存在塑料瓶中④AgNO3固体保存在棕色试剂瓶内⑤浓硝酸保存在棕色广口瓶内
A.①③④ B.③④ C.①②③④ D.①②③④⑤
2.下列除去杂质的操作方法正确的是
A.食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干
B. NO2中有少量的NO:通入适量的氧气
C.CO2中混有少量的HCl:通过饱和的NaHCO3溶液后再干燥
D.红磷中有少量的白磷:加热到40℃,使白磷自燃
3.氢叠氮酸(HN3)与醋酸酸性相近, 其盐稳定, 但撞击发生爆炸生成氮气, 有关氢叠氮酸的叙述中正确的是
①NaN3的水溶液呈碱性 ②HN3的固体属于分子晶体 ③NaN3的固体属于离子晶体 ④NaN3可用于小汽车防撞保护气囊
A.①②③ B.②③④ C.①③④ D.全对
4.下列关于浓HNO3与浓H2SO4的叙述正确的是
A.都可用铁制容器贮存 B.常温下都能与铜较快反应
C.露置于空气中,溶液质量均减轻 D.露置于空气中,溶液浓度均降低
5. 往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸,溶液的颜色变化应该是
A.颜色变浅 B.变为深绿色 C.没有改变 D.变棕黄色
6.已知某溶液中存在OH-、H+、NH4和Cl-四种离子,其浓度大小有如下关系:
①c (Cl-)> c (NH4+)> c (H+)> c (OH-) ②c (Cl-)> c (H+)> c (NH4+)> c (OH-)
③c (Cl-)= c (NH4+)且c (OH-)= c (H+) ④c (OH-)> c (H+)> c (Cl-)> c (NH4+)
⑤c (H+)> c (OH-)> c (Cl-)> c (NH4+)。其中可能的是
A.①④ B.③⑤ C.①②③ D.④⑤
7.氮和钠可形成化合物Na3N,它能与水剧烈反应产生NH3,下列叙述正确的是
A.Na3N与水的反应是氧化还原反应 B.Na3N 是共价化合物
C.Na3N若与足量盐酸作用可生成两种盐 D.Na3N中钠离子与氮离子半径相等
8.1.92g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积是
A.504mL B.168mL C.336mL D.224mL
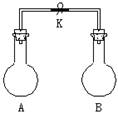 9.如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是
9.如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是
| 编 号 | ① | ② | ③ | ④ |
| A中气体 | H2S | H2 | NH3 | NO |
| B中气体 | SO2 | Cl2 | HCl | O2 |
A. ②③④① B. ③①④② C. ③②①④ D. ④③②①
10.下列说法正确的是
A.相同温度下,1 mol·L-1氨水溶液与0.5 mol·L-1氨水溶液中,[OH-]之比是2:1
B.在NH3+NaH=NaNH2+H2↑的反应中,NaH为氧化剂
C.0.1 mol·L-1 NH4Cl溶液中的c(NH4+)=c(Cl-)
D.0.2 mol·L-1氨水溶液中,c(NH4+)+c(NH3)+ c(NH3•H2O)= 0.2 mol·L-1
11.液氨溶解碱金属后成为蓝色的导电能力很强的溶液,其颜色被认为是反应生成的电子的氨合物[e(NH3)n]引起的,若放置蓝色逐渐褪去,蒸发褪色后的溶液可以得到白色的氨基钠(NaNH2),反应方程式为:2Na + 2NH3 = 2NaNH2 + H2 ↑ ,据此有关说法不正确的是
A.溶液褪色速率与逸出氢气的速率相对应 B.液氨中有电离过程:2NH3 = NH4+ + NH2-
C.碱金属的液氨溶液是强还原剂 D.液氨是一种非电解质 ,在水中才能电离
12.10.8g氮的氧化物NxOy 和50g灼热的铁在密闭真空容器中反应一段时间后,生成0.1mol Fe3O4和0.1mol N2,则NxOy是
| pH 0 20 50 V mL |
 A.NO B. N2O3
C. NO2 D.N2O5
A.NO B. N2O3
C. NO2 D.N2O5
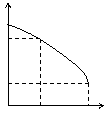
13.将H3PO4溶液逐滴加到60mL的Ba(OH)2溶液中,溶液的pH值与所加H3PO4的体积之间的关系如右图所示(溶液总体积看作两溶液混合后的体积之和),下列说法正确的是
A.c(H3PO4)=0.05mol/L B.pH=7时生成沉淀1.2g
C.pH=a时,生成沉淀0.48g D.pH=a时,溶液中c(OH-)=0.045mol/L
14.工业废气中氮氧化物是主要的大气污染源之一。
已知2NO2+2NaOH=NaNO3+NaNO2+H2O, NO2+NO+2NaOH=2NaNO2+H2O。
现有a mol NO2和b mol NO的混合气,若用足量的NaOH溶液将其完全吸收,则混合气中两种气体的物质的量必须满足的关系是
A.a=b/3 B.2a=b C.a≥b D.a<b
15.某单质能跟浓HNO3 反应,若参与反应的单质与硝酸的物质的量之比为1:4,则该元素在反应中所显示的化合价可能是
(1)+1 (2)+2 (3)+3 (4)+4
A.(1)(2)(3)(4) B.(1)(2) C.(3)(4) D.(2)(4)
班级 姓名 成绩
选择题答题卡
| 1 |
| 2 |
| 3 |
| 4 |
| 5 |
| 6 |
| 7 |
| 8 |
|
| 9 |
| 10 |
| 11 |
| 12 |
| 13 |
| 14 |
| 15 |
|
| |
二、填空题(共21分)
16.(4分)久置的浓硝酸发黄是因为 ;液氨常用做制冷剂,其原因是 ;实验室制氨的化学反应方程式是_________________________ ___,用__________ ______检验NH3是否充满。
17. (4分)一种蜡状固体在空气中完全燃烧生成白色粉末X,将X加入冷水中生成含氧酸Y,将X加入热水中生成含氧酸Z,从以上实验现象可判断此蜡状固体是 ,X是 ,Y是 ,Z是 。
18. (4分)某化肥厂用NH3制硝酸,再进一步制NH4NO3,已知NH3制HNO3时产率为88%,由NH3与HNO3反应制NH4NO3时产率为98%。若用100t NH3制NH4NO3时,用于制HNO3的氨为多少 t,可制出NH4NO3 t。
19. (4分)在标准状况下,1体积水溶解700体积氨气,所得溶液的密度为0.9g/mL,则(1)氨水的质量分数是 ;该氨水的物质的量浓度是 。
20. (4分)NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。请回答下列问题。
(1)NO对环境的危害在于 (填以下项目的编号)
A.破坏臭氧层 B.高温下能使一些金属被氧化
C.造成酸雨 D.与人体血红蛋白结合
(2)在含Cu+ 离子的酶活化中心中,亚硝酸根离子(NO2-)可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式: 。
(3)在常温下,把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式: 。
(4)解释变化(3)中为什么最后的气体总压力小于原压力的2/3 。
三、实验题(共11分)
21.下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
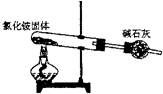
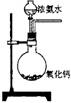


A B C D
 22.铜与浓硝酸反应和铜与稀硝酸反应,产物不同,实验现象也不同。
22.铜与浓硝酸反应和铜与稀硝酸反应,产物不同,实验现象也不同。
(1)某研究性学习小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实现装置。请你根据他们的思路,选择下列药品,完成该实验,并叙述实验步骤。
药品:稀硝酸、稀盐酸、Zn粒、CaCO3固体
步骤:①检查装置的气密性;
②
③
④
⑤
⑥用注射器向试管内推入氧气(或空气)
(2)推入氧气或空气的目的是 。
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异引起的,你是否同意这种看法? (填“同意”或“不同意”),原因是 ;另一同学提出溶液呈“绿色”是Cu2+与NO2混合的结果,请你设计一个实现证明之。(简述实验方案和实验现象)
四、计算题(共8分)
23.现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为amol ,Cu的物质的量分数为x;研成粉末后,全部投入含bmolHNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1)用微粒符号填写下列空白(列举出全部可能的情况)。
| ① | ② | ③ | ④ | |||
| 残留固体成份 | ||||||
| 溶液中的金属离子 |
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示) 。
(3)当x=0.5时,溶液中Fe3+ 与Fe2+的物质的量相等时,在标准状况共产生672mL气体。求a、b的值
《氮族元素》参考答案
选择题答题卡
| 1 | A | 2 | C | 3 | D | 4 | D | 5 | D | 6 | C | 7 | C | 8 | C |
| 9 | B | 10 | D | 11 | D | 12 | C | 13 | D | 14 | C | 15 | D |
| |
16.浓硝酸分解生成的NO2溶于浓硝酸所致;气化时需要吸收大量的热; 2NH4Cl+Ca(OH)2 ![]() 2NH3↑+ 2 H2O + CaCl2
;润湿的红色湿润试纸。
2NH3↑+ 2 H2O + CaCl2
;润湿的红色湿润试纸。
17.P4;P2O5;HPO3;H3PO4。
18.53.2;220.3。
19.34.7%;18.3.
20.(1)AC;(2)Cu++NO2-+2H+= Cu2++NO+H2O;(3)3NO
![]() N2O+NO2;(4)这是因为NO2与N2O4存在如下的平衡:2 NO2
N2O+NO2;(4)这是因为NO2与N2O4存在如下的平衡:2 NO2 ![]() N2O4,加压平衡右移,故略小于2/3。
N2O4,加压平衡右移,故略小于2/3。
21.AC
22.(1) ②向试管中加入一定量的CaCO3固体;
③向试管中加入过量的稀HNO3,并迅速盖上带铜丝和导管的橡皮塞
④待反应完成后,将右边导管插入试管接近液面处 ⑤将铜丝插入到溶液中
(2)检验生成的气体是NO气体。
(3) 不同意。 铜片质量相同,溶液体积相同,浓度相同。
加热绿色溶液,有红棕色气体产生,溶液变蓝色。
23.(1)
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 溶液中的金属离子 | Fe2+ | Fe2+ | Fe2+、Cu2+ | Fe2+、Cu2+ | Fe2+ 、Fe3+ 、Cu2+ | Cu2+、Fe3+ |
| 残留固体成分 | Fe、Cu | Cu | Cu | — | — | — |
(2)8a(1-x)/3 < b ≤8a/3
(3)a=1.04mol b=0.12mol