高二第一学期期中考试化学试卷3
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。满分为100分,答题时间为90分钟。
可能用到的数学:lg2=0.301
第I卷(选择题,共66分)
一、选择题:(共48分,每小题只有一个正确答案,每题3分)
1.在2L的密闭容器中发生下面反应:A(g)+2B(g)=3C(g),经过3min后A的物质由10mol
变为7mol,则下面表示的反应速率正确的是 ( )
A.vA=1mol·L-1·min-1 B.vB=1mol·L-1·min-1
C.vC=2mol·L-1·min-1 D.vB=2mol·L-1·min-1
2.已知4NH3+5O2=4NO+6H2O,正确的关系是 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
![]() 3.在2A+B
3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的
3.在2A+B
3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的
是 ( )
A.vA=0.5mol·L-1·min-1 B.vB=0.3mol·L-1·min-1
C.vC=0.8mol·L-1·min-1 D.vD=1mol·L-1·min-1
4.区分强电解质和弱电解质的依据是 ( )
A.溶解度的大小 B.属于离子化合物还是共价化合物
C.是否存在电离平衡 D.导电性的强弱
5.下列物质在水溶液中,存在电离平衡的是 ( )
A.NaOH B.CH3COOH C.BaSO4 D.CH3COONa
6.25℃时某溶液中由水电离出的c(OH-)为1×10-11mol/L,则该溶液的PH可能等于( )
①11 ②8 ③7 ④3
A.①④ B.①② C.①③ D.②③
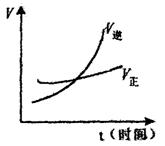
![]() 7.下列各图中能表示A(g)+B(g) =2C(g)(睚反应为放热反应)这个可逆反应的为( )
7.下列各图中能表示A(g)+B(g) =2C(g)(睚反应为放热反应)这个可逆反应的为( )
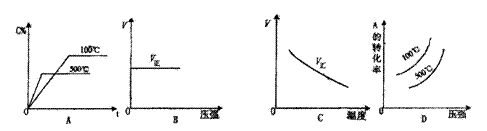
![]() 8.在一定条件下,可逆反应X(g)+3Y(g)
2Z(g)进行一段时间后,测得Y的转化率
8.在一定条件下,可逆反应X(g)+3Y(g)
2Z(g)进行一段时间后,测得Y的转化率
为37.5%,X的转化率为25%。则反应开始后,充入容器中的X和Y的物质的量之比为( )
A.1:3 B.3:1 C.1:2 D.2:1
9.相同温度下,c(H+)相同的硫酸、盐酸和醋酸物质的量浓度关系正确的是 ( )
A.CCH3COOH>CHCl>CH2SO4 B.CH2SO4 >CHCl > CCH3COOH
C.CHCl>CH2SO4 > CCH3COOH D.CHCl > CCH3COOH> CH2SO4
![]() 10.在一密闭容器中充入一定量的H2和N2发生反应N2+3H2 2NH3
,经测定3秒末
10.在一密闭容器中充入一定量的H2和N2发生反应N2+3H2 2NH3
,经测定3秒末
的氢气的反应速率为0.3mol·L-1·S-1,则6秒末NH3的浓度为 ( )
A.1.2mol/L B.大于1.2mol/L C.小于1.2mol/L D.不能确定
|
关系是 ( )
A.m>n
B.m<n
C.m=n
D.无法确定
12.常温下,若200mlc(H+)=1×10-3mol/L的某一元酸和100mlc(OH-)=1×10-3mol/L的某一元
碱溶液混合后,溶液PH>7,所用的酸和碱可能是 ( )
A.等浓度的弱酸和强碱 B.衡的强酸和稀的强碱
C.稀的弱酸和浓的强碱 D.稀的强酸和浓的弱碱
![]() 13.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则 ( )
13.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则 ( )
A.平衡向正反应方向移动了 B.物质A的转化率小了
C.物质B的质量分数减小了 D.a>b
![]() 14.在密闭容器中进行如下反应:H2(g)+I2(g) 2HI(g), 已知起始浓度CH2=0.1mol/L,
14.在密闭容器中进行如下反应:H2(g)+I2(g) 2HI(g), 已知起始浓度CH2=0.1mol/L,
CI2=0.3mol/L,CHI=0.2mol/L,在一定条件下达到平衡时,各物质的浓度不可能是( )
A.CH2=0.2mol/L B.CI2=0.34mol/L C.CHI=0.35mol/L D.C.CHI=0.18mol/L
15.把体积相同,c(H+)相同的两份酸溶液,甲为盐酸,乙为醋酸,分别与锌反应,若反应后
放出氢气一样多,有一份中锌有剩余,以下判断正确的是 ( )
①反应所需时间乙>甲 ②开始反应速率甲>乙
③参加反应的锌的质量甲=乙 ④整个阶段平均反应速率乙>甲
⑤盛盐酸溶液中锌有剩余 ⑥盛醋酸的锌有剩余
A.①②③ B.①③⑥ C.②③⑥ D.③④⑤
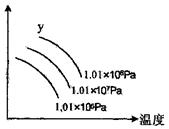
![]() 16.右图表示外界温度和压强对反应L(s)+G(g)
2R(g)(正反应是吸热)的影响,图
16.右图表示外界温度和压强对反应L(s)+G(g)
2R(g)(正反应是吸热)的影响,图
|
A.平衡混合气中R的体积分数
B.平衡混合气中G的体积分数
C.L的转化率
D.R的产率
二、选择题:(共18分,每小题只有一个正确答案,每题3分)
![]() 17.已知可逆反应A+2B 2M+N(正反应为放热反应),在一定条件下达到平衡时,A在反应混合物中的质量分数为a%,若要通过改变条件使A的质量分数变为2a%,则下列各项可改变的条件中,一定能达到目的的是(其中a<50) ( )
17.已知可逆反应A+2B 2M+N(正反应为放热反应),在一定条件下达到平衡时,A在反应混合物中的质量分数为a%,若要通过改变条件使A的质量分数变为2a%,则下列各项可改变的条件中,一定能达到目的的是(其中a<50) ( )
A.增大容器体积 B.增大反应容器内压强
C.升高反应温度 D.使用适量催化剂
18.将体积都为10mL,pH都等于12的氨水和氢氧化钠,分别加水稀释到a mL和b Ml,测
得稀释后两溶液的pH值都等于10,则a与b的关系是 ( )
A.a=b=100mL B.a=b=1000mL C.a<b D.a>b
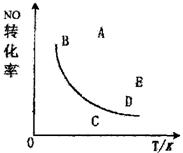
19.如右图曲线,在其他条件一定时,反应2NO+O2=2NO2+Q(Q>0)中NO的最大转化率
|
A.A或E
B.C
C.B
D.D
![]() 20.在3NO2+H2O
2HNO3+NO平衡体系中通入O2,则化学平衡 ( )
20.在3NO2+H2O
2HNO3+NO平衡体系中通入O2,则化学平衡 ( )
A.不移动 B.向生成HNO3的方向移动
C.最终向生成NO2的方向移动 D.移动方向视通入O2的量而定
![]() 21.在某温度下,可逆反应mA+nB pC+qD平衡常数为K,下列说法正确的是( )
21.在某温度下,可逆反应mA+nB pC+qD平衡常数为K,下列说法正确的是( )
A.K越大,达到平衡时,反应进行的程度越大
B.K越小,达到平衡时,反应物的转化率越大
C.K随反应物浓度的改变而改变
D.K随着温度的升高而增大
22.将pH=5的盐酸溶液稀释1000倍后,溶液的pH为 ( )
A.等于8 B.等于7 C.略小于7 D.略大于7
第Ⅱ卷(非选择题,共34分)
三、填空题:(共23分)
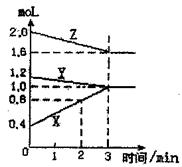
|
(1)该反应的化学方程式为
(2)反应开始至2分钟末,X的反应速率为:
(3)该反应是由 开始反应的(正、逆或
正逆同时)
![]() 2.(5分)25℃时,纯水中c(H+)·c(OH-)=1×10-14;100℃时,纯水中c(H+)·c(OH-)=1×10-12,说明温度升高,水的离子积常数变
,这是因为水的电离H2O H++OH-是
热反应。25℃时,在酸、碱的稀溶液中c(H+)·c(OH-)=
,这常数称为
,某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时
2.(5分)25℃时,纯水中c(H+)·c(OH-)=1×10-14;100℃时,纯水中c(H+)·c(OH-)=1×10-12,说明温度升高,水的离子积常数变
,这是因为水的电离H2O H++OH-是
热反应。25℃时,在酸、碱的稀溶液中c(H+)·c(OH-)=
,这常数称为
,某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时
c(OH-)= 。
![]() 3.(4分)在100℃和200kPa的条件下,反应aA(g) bB(g)+c
C(g)建立平衡后,在不
3.(4分)在100℃和200kPa的条件下,反应aA(g) bB(g)+c
C(g)建立平衡后,在不
加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反
应建立平衡时物质B的浓度。
| 压强(kPa) | 200 | 500 | 1000 |
| B的浓度(mol/L) | 0.04 | 0.1 | 0.27 |
根据表中的数据,回答下列问题:
(1)压强从200kPa增加到500kPa时,平衡 转移(填“正向”或“逆向”或“不”),理由是 。
(2)压强从500kPa增加到1000kPa时,平衡 方向转移(填“正向”或“逆向”或“不”),其原因可能为 。
4.(8分)在一定温度下,10L密闭容器中加入5molSO2、3molO2,反应达平衡时有3molSO2发生了反应。试填写下列空格:
①生成SO3 mol;
②O2的转化率为 ;
③平衡时容器内气体总物质的量为 mol;
④平衡时体系中SO3的百 分含量(体积分数)为 ;
⑤平衡时s(SO2)= mol/L;c(O2)= mol/L; c(SO3)= mol/L;
⑥若反应前容器内压强为p1,则平衡时容器内的压强为 (用p1表示)
四、计算题:(共11分)
1.(6分)若设混合后的溶液体积为原混合液体积之和,计算下列混合液的PH。
(1)pH=3和pH=6的盐酸溶液等体积混合
(2)pH=12的NaOH溶液和pH=9的Ba(OH)2溶液等体积混合。
2.(5分)有平均相对分子质量为8.5的氮、氢混合气体,通过合成塔出来的混合气体平均分子质量为9.44,求氮气的转化率。
高二化学试卷答案
一、(共48分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| B | D | B | C | B | A | A | D |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| A | C | B | D | A | A | D | B |
二、(共18分)
| 17 | 18 | 19 | 20 | 21 | 22 |
| C | D | B | B | A | C |
第Ⅱ卷(非选择题、共34分)
三、填空题:(共23分)
![]() 1.(1)Y+2Z 3X (2)1mol·L-1·min-1 (3)正逆同时开始
1.(1)Y+2Z 3X (2)1mol·L-1·min-1 (3)正逆同时开始
2.变大、吸、1×10-14、水的离子积常数、2×10-17 mol·L-1
3.(1)不移动、浓度增大的倍数和压强增大的倍数相同
(2)正向、加压至1000KPa时C物质变成了非气态物质
4.①3mol ②50% ③6.5mol ④46.15% ⑤c(SO2)=0.2mol/L; c(O2)=0.15mol/L;
c(SO3)=0.3mol/L; ⑥0.8125P1
四、计算题:(共11分)
1.(1)2.7 (2)11.7
2.20%