高二第一学期期中考试化学试卷(理科)
班级:___________ 姓名:______________ 序号:___________ 得分:_______________
可能用到的部分相对原子质量:Cn — 64,Ba — 137,S — 32,N — 14
一、选择题(每小题只有一个选项符合题意,请将正确答案填入答题栏中,1~10题每题2分,11~20题每题3分,共50分)
1、下列元素按非金属性逐渐增强顺序排列正确的是:
A、N、P、As B、P、S、F C、N、C 、O D、O、F、Cl
2、要检验市面上的金器首饰是否用纯金制成,可取样品与某种试剂进行反应,根据实验现象即可判断,所用试剂是:
A、稀硫酸 B、浓盐酸 C、浓硝酸 D、王水
3、下列气体能造成空气中光化学 污染的是:
A、CO B、SO2 C、NO2 D、Cl2
4、下列关于N60的说法不正确的是:
A、N60和14N都是氮的同位素 B、N60和14N互为同素异形体
C、N60的摩尔质量为840g/mol D、N60分子为非极性分子
5、为除去镀在铝表面的铜镀层,可选用的试剂是:
A、浓硫酸 B、稀硝酸 C、浓盐酸 D、浓硝酸
6、某元素R的原子最外层上有5个电子,它的依据含氧酸钾盐的化学 式不可能是:
A、K3RO4 B、K2RO4 C、KRO3 D、KRO2
7、下列几种混合气体分别通入水中,其中一种气体消失另一种气体体积增大的是:
A、NH3、NO2 B、HCl、SO2 C、HF、O2 D、NO2、NO
8、已知一般情况下溶质易溶于极性与其相似的溶剂里,这种现象称之为"相似相溶原理"。对下列物质溶解性的叙述不正确的是:
A、I易溶于CCl4 B、百磷易溶于 CS2 C、NH4Cl易溶于酒精 D、NH3易溶于水
9、下列说法中不正确的是:
A、百磷在空气中加到260℃可转化为红磷
B、向变黄的浓硝酸中通入空气可使其黄色消失
C、升高温度一定能使 化学 平衡发生移动
D、化学 平衡右移,反应物的转化率可能增大,也可能减小。
10、在一定温度下,可逆反应 达到平衡的标志是:
A、单位时间内生成2molC同时消耗1molA
B、单位时间内生成nmolA同时生成3nmolB
C、A、B、C、的浓度不再变化
D、A、B、C、分子数之比为1:3:2
11、在反应X + 2Y = R + 2M中,已知R和M的摩尔质量之比是22:9。当1.6gX和Y完全反应后,生成4.4gR,则反应中Y和M的质量之比为:
A、46:9 B、32:9 C、23:9 D、16:9
12、在密闭容器中进行反应,X2(g) + Y2(g)![]() 2Z(g)已知X2、Y2、Z的起始浓度分别为0.1mol/L
、0.2mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是:
2Z(g)已知X2、Y2、Z的起始浓度分别为0.1mol/L
、0.2mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是:
A、Z为0.3mol/L B、Y2为0.35mol/L C、X2为0.2mol/L D、Z为0.4mol/L
13、在密闭容器中发生反应:aX(g) +bY(g)![]() cZ(g) + dW(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确的是:
cZ(g) + dW(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确的是:
A、平衡向正反应方向移动 B、(a + b)>(c + d) C、X的转化率变小 D、Z的体积分数变大
14、在N2 + 3H2![]() 2NH3 反应中,经过一段时间后,NH3的浓度增加了0.6mol/l,此段时间内用H2表示的平均反应速率为0.45mol/(L·s)。则此段时间值是:
2NH3 反应中,经过一段时间后,NH3的浓度增加了0.6mol/l,此段时间内用H2表示的平均反应速率为0.45mol/(L·s)。则此段时间值是:
A、2S B、1S C、0.44S D、1.33S
15、阿罗波宇宙飞船升空以N2H4(联氨)和N2O4为推力源,反应温度高达270℃,反应式为 对于该反应下列说法不正确的是:
A、联氨作还原剂 B、每燃烧1mol N2H4有3mol 电子发生转移
C、每生成1molN2,被还原的N原子为![]() mol
D、N2既是氧化产物又是还原产物
mol
D、N2既是氧化产物又是还原产物
16、一定条件下的可逆反应:N2(g) + 3H2(g)![]() 2NH3(g)(正反应放热)的图象不正确的是:
2NH3(g)(正反应放热)的图象不正确的是:
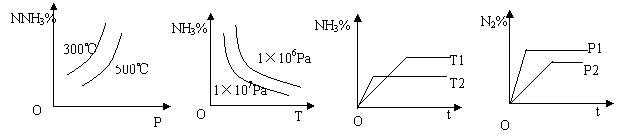
A、 B、 C、 D、
17、在容积不变的密闭器中,一定条件下发生下列可逆反应:
2A![]() B(g) + C(s)且达到化学平衡。当升高温度时,其容器内气体的密度增大,下列说法中正确的是:
B(g) + C(s)且达到化学平衡。当升高温度时,其容器内气体的密度增大,下列说法中正确的是:
A、若正反应为吸热反应,则A为气态
B、若正反应为放热反应,则A为气态
C、在平衡体系中加入少量C,该平衡向逆反应方向移动
D、压强对该反应的平衡移动无影响
18、在体积为VL的密闭容器中,通入amol和bmol ,反应后容器内N原子和O原子的物质的量之比为:
A、a/b B、a/(a + 2b) C、a/2b D、a/(2a + 2b)
19、氢阴离子(H-)能和NH3反应:H- + NH3== NH2- + H2 ,据此反应事实可以得出的正确结论是
A、NH3有还原性 B、H2为还原产物 C、H-是很强的还原剂 D、该反应属置换反应
20、有下列几种粒子:OH-、Na+、NH4+、NH3、Mg2+、H+其中在溶液中能两两发生反应的共有:
A、四组 B、五组 C、六组 D、七组
| 答案 | ||||||||||
| 题号 | ||||||||||
| 答案 | ||||||||||
| 题号 |
二、填空题(共16分)
21、(4分)在一定条件下,RO3n-和F2可发生如下反应:RO3n- + F2 + 2OH-== = RO4- + 2F- + H2O,由此可得RO3n-中的n值为_____、R原子的最外层电子数为_________
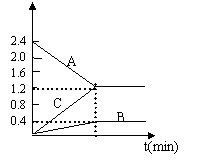
|
(1)该反应的反应物是:________
(2)该反应的化学方程式为:________
(3)若达到平衡状态的时间是2min,A物质的平均反应速率为________。
23、(6分)在一定温度下,把2molSO2和 1molO2 通入固定体积的密闭容器里,发生如下反应:
2SO2 + O2 ![]() 2SO3当此反应进行一定程度时,反应混合物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的SO2、O2、SO3的物质的量(mol)。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时完全相同,请填写下列空白:
2SO3当此反应进行一定程度时,反应混合物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的SO2、O2、SO3的物质的量(mol)。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时完全相同,请填写下列空白:
(1)C的最大值可等于________
(2)a、b、c取值必须满足的一般条件是(用二个方程式表示,其中一个只含a和c,另一个只含b和c):________________、________。
三、推断题(共23分)
24、(6分)某物质A为白色粉末,易溶于水。向A的溶液中加入AgNO3溶液,产生白色沉淀,再加稀硝酸沉淀不溶解。加取少量A物质的溶液,加入NaOH溶液,并加热,产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变蓝,试回答:
(1)A的化学式是:________
(2)A与AgNO3溶液反应,A与NaOH溶液反应的离子方程式分别是:
________________________________、________________________________。
25、(18分)如图是A~E五种相互转化关系图,其中A、B、C、D常温下均为气体,且A为单质,B为红棕色气体。
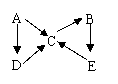 (1)写出C和E的化学式________,________。
(1)写出C和E的化学式________,________。
(2)写出A分子的电子式________。
(3)D的分子构型为________;
D转化为C的化学方程式为________。
(4)实验室制取C,只能用________法收集,制取D只能用________分收集,干燥D可用________。
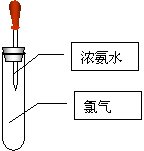
![]() 26、(9分)如图所示:试管中集满干燥的氯气,胶头滴管中装有供反应的足量浓氨水。滴入浓氨水,开始时试管内发生的反应有氧化还原反应:NH3 + Cl2 == N2 + HCl(未配平),并产生红光和白烟。请根据以上反应和现象回答下列问题:
26、(9分)如图所示:试管中集满干燥的氯气,胶头滴管中装有供反应的足量浓氨水。滴入浓氨水,开始时试管内发生的反应有氧化还原反应:NH3 + Cl2 == N2 + HCl(未配平),并产生红光和白烟。请根据以上反应和现象回答下列问题:
(1)标志反应全部完成的现象是________
(2)反应产生的白烟的主要成份是________
![]()
![]() (3)反应完毕后,将试管浸入水中并倒立,取下滴管,
(3)反应完毕后,将试管浸入水中并倒立,取下滴管,
![]()
![]() 有水进入试管。在室温时,进入试管内的水约占
有水进入试管。在室温时,进入试管内的水约占
试管容积的________
四、计算题(共11分,两 题任选 一题)
27、在浓硝酸中入入铜片
(1)开始反应时产生的气体是________,或铜有剩余,则反应将要结束时产生的气体是________,待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,该气体是________
(2)加入稀硫酸又产生气泡的原因是________。
(3)若将12.8g铜跟 一定量浓硝酸反应,铜消耗完时,共产生标准状况下的气体5.6L,则所消耗的硝酸的物质的量为________,所得气体的平均相对分子质量为________
28、50ml0.2mol·L-1溶液与15g10%的H2SO4溶液(密度为1.9g·cm-3)混合,计算:
(1)生成沉淀的质量:
(2)反应结束后,溶液中剩余物质(酸或盐)的物质的量浓度(设溶液的总体积不变)。