| |
一、选择题(每小题只有一个选项符合题意。每小题2分,本题共20分。)
1. 在四个不同的容器中,在不同的条件下进行合成氨的反应。根据下列在相同时间内测定的结果判断生成氨的速率最大的是
A.ν(H2)=0.1mol/(L·min) B. ν(N2)=0.1mol/(L·min)
C.ν(N2)=0.2mol/(L·min) D. ν(NH3)=0.3mol/(L·min)
2.相同条件下,向某一固定体积的密闭容器中按下列各组物质的量加入H2、N2、NH3, 反应达平衡时,氨气浓度最大的一组是
|
| A | B | C | D |
| H2 | 6 | 1 | 3.5 | 5 |
| N2 | 2 | 0 | 1 | 1.5 |
| NH3 | 0 | 4 | 2 | 1 |
3.可充分说明可逆反应:P(g)+Q(g) ![]() R(g)+S(g),在恒温下达到平衡状态的标志是
R(g)+S(g),在恒温下达到平衡状态的标志是
A.反应器内压强不随时间变化而变化
B.反应器内P、Q、R、S四种气体共存
C.生成P的速率与生成S的速率相等
D.生成1molP同时必有1molQ生成
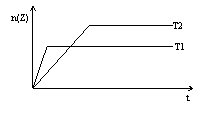 4.反应2X(g)+Y(g)
4.反应2X(g)+Y(g) ![]() 2Z(g)在不同温度下(T1和T2)产物Z的物质的量n(Z)与反应时间t的关系如右图。下列判断正确的是
2Z(g)在不同温度下(T1和T2)产物Z的物质的量n(Z)与反应时间t的关系如右图。下列判断正确的是
A. T1<T2 , 正反应为放热反应
B. T1>T2 ,正反应为吸热反应
C. T1>T2 ,逆反应为吸热反应
D. T1<T2 ,逆反应为放热反应
5.在含有酚酞的0.1mol/L氨水中加入少量的NH4Cl晶体,则溶液颜色
A.变蓝色 B.变深 C.变浅 D.不变
6.用0.1mol/L的盐酸跟0.06mol/L氢氧化钡溶液等体积混合,则混合溶液的pH为
A. 2 B. 1.7 C. 12 D. 12.3
7.下列有关叙述不正确的是
A.纯净的强电解质在液态时有的导电,有的不导电
B.同温度、同浓度时,弱电解质的导电能力一定比强电解质的导电能力弱
C.电解质溶液导电能力的强弱,取决于溶液中电解质的物质的量浓度
D.已达到电离平衡的溶液,当温度升高时电离平衡会发生移动
8.已知溶液中水电离出来的氢离子浓度为10-13mol/L,在此溶液中肯定能大量共存的离子组是
A. Na+、Ba2+、Cl-、NO3- B.SO32-、Cl-、Na+、SO42-
C.NH4+、K+、NO3-、SO42- D.Al3+、Cl-、Na+、AlO2-
9.用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减少的是
A.![]() B.
B.![]()
C. C(H+)和C(OH-)的乘积 D.![]()
10.下列离子方程式中正确的是
A.氢氧化钡溶液和过量的硫酸氢钠溶液反应
Ba2++OH-+H++SO42-==BaSO4↓+H2O
B.将过量二氧化硫通入氢氧化钠溶液
SO2+2OH- ==SO32-+H2O
C.将氯气通入氯化亚铁溶液中
2Fe2++Cl2==2Fe3++2Cl-
D.三氯化铁在溶液中发生水解反应
Fe3++3H2O==Fe(OH)3↓+3H+
二、选择题(每小题有1-2个选项符合题意。每小题3分,共30分。)
11.反应NH4HS(s) ![]() NH3(g)+H2S(g)在某一温度下达到平衡时,下列各种情况中,不能使平衡发生移动的是
NH3(g)+H2S(g)在某一温度下达到平衡时,下列各种情况中,不能使平衡发生移动的是
A.其他条件不变,通入SO2气体 B.加入一部分NH4HS固体
C.保持容器体积不变,充入氮气 D.保持容器体积不变,通入氯气
12.在密闭容器中发生下列反应:aX(g)+bY(g) ![]() cZ(g)+dW(g) 反应达平衡后将气体体积缩小为原体积的1/2,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列说法正确的是
cZ(g)+dW(g) 反应达平衡后将气体体积缩小为原体积的1/2,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列说法正确的是
A.平衡向逆反应方向移动 B. a+b>c+d
C.Z的体积分数增大 D.X的转化率减小
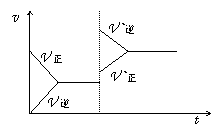 13.对于可逆反应x+y
13.对于可逆反应x+y![]() z+w达平衡后,在其他条件不变的情况下,增大压强,反应速率变化如右图。
z+w达平衡后,在其他条件不变的情况下,增大压强,反应速率变化如右图。
判断四种物质的状态正确的是
A.四种物质均为气体
B.x、y均为气体,z、w中有一种为气体
C.z、w中有一种为气体,x、y皆非气体
D.z、w均为气体,x、y中有一种为气体
14.有两只密闭容器甲和乙,甲容器有一个可移动的活塞,能使容器内保持恒压,乙容器能保持恒容。起始时分别向两容器内充入2molSO2和1molO2,在相同的温度和压强下开始发生下列反应:2SO2+O2![]() 2SO3,并达到平衡。下列叙述正确的是
2SO3,并达到平衡。下列叙述正确的是
A.平均反应速率:甲>乙 B.平衡时O2的物质的量:甲<乙
C.平衡时SO2的转化率:甲>乙 D.平衡时SO3的体积分数:甲<乙
15.为了使(NH4)2SO4溶液中C(NH4+)和C(SO42-)之比更接近于2:1,可向溶液中滴加少量的
A. H2SO4 B.盐酸 C.NaOH溶液 D.NaCl溶液
16.下列事实①NaHCO3溶液呈碱性 ②NaHSO4溶液呈酸性 ③长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结 ④加热能增加纯碱的去污能力 ⑤配制CuCl2溶液,用稀盐酸溶解CuCl2固体 ⑥明矾能净水 ⑦氯化铵溶液可作焊药去除金属制品表面的锈斑 ⑧加热FeCl3·6H2O晶体,往往得不到FeCl3固体 ⑨NH4F溶液不能用玻璃瓶盛放。其中与盐类水解有关的是
A.全部 B.除②⑦以外 C.除②以外 D.除⑨以外
17.取pH均等于2的盐酸和醋酸各100mL,分别稀释两倍后,再分别加入0.03g锌粉,相同条件下充分反应,有关叙述正确的是
A.醋酸与锌反应放出的氢气多
B.盐酸、醋酸分别与锌反应放出的氢气一样多
C.醋酸与锌反应速率大
D.盐酸、醋酸分别与锌反应的速率一样大
18.等体积、等浓度的MOH强碱溶液和HA弱酸溶液混合后,混合液中有关离子浓度满足的关系是
A. C(M+)>C(OH-)>C(A-)>C(H+)
B. C(M+)>C(A-)>C(H+)>C(OH-)
C. C(M+)>C(A-)>C(OH-)>C(H+)
D. C(M+)+C(H+) == C(A-)+C(OH-)
19.相同物质的量浓度的两盐溶液NaA溶液和NaB溶液比较,NaA溶液的pH较大。则下列有关同温、同体积、同浓度的HA和HB溶液的叙述中正确的是
A.电离常数:HA>HB B.pH: HA<HB
C.与NaOH恰好完全反应时,消耗的NaOH的物质的量:n(HA)<n(HB)
D.溶液中酸根离子的浓度:C(B-)>C(A-)
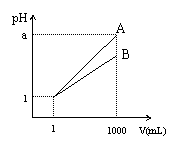 20. pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH
20. pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH
与溶液体积的关系如右图所示。下列说法正确的是
A. A、B两种酸溶液的物质的量浓度一定相等
B. 稀释后的A酸溶液的酸性比B酸溶液的酸性强
C. 若a=4,则A是强酸,B是弱酸
D. 若1<a<4,则A、B都是弱酸
三、填空题
21.按要求写出下列变化的离子方程式或电离方程式:
⑴硫氢化钠溶液中除存在水的电离平衡外,还存在以下两个平衡体系
① ② 。
⑵氨水与醋酸混合反应
⑶碳酸氢钠溶液与硫酸铝溶液混合反应
⑷硫酸铜溶液与硫化钠溶液混合反应
⑸三氯化铁与硫氰化钾溶液混合反应
⑹氯气通入水中
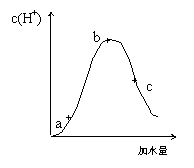 22.25℃时,对冰醋酸进行稀释实验,溶液中氢离子浓度随加水量的变化如下图所示:
22.25℃时,对冰醋酸进行稀释实验,溶液中氢离子浓度随加水量的变化如下图所示:
在a、b、c三点中
⑴氢离子浓度由大到小的顺序为
⑵电解质总浓度由大到小的顺序为
⑶溶液导电性由强到弱的顺序为
⑷b、c两点中由水电离产生的氢离子浓度较
大的是 。
23.在一定条件下,可逆反应:mA+nB![]() pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是 。
(2)A、C是气体,增加B的量,平衡不移动,则B为 态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是 。
(4)加热后,可使C的质量增加,则正反应是 反应(放热或吸热)。
24.PH的测定与计算在科研与生产领域有着重要应用。请利用pH的相关知识解答以下两小题:
(1)有0.1mol/L的下列溶液:①Na2SO4②Na2CO3③NaHCO3④NH4Cl⑤NaOH⑥Ba(OH)2⑦H2SO4⑧HCl⑨CH3COOH 请按pH由小到大的顺序把它们排列起来(填序号) 。
(2)25℃时,将100体积pH=a的某强碱与1体积pH=b的某强酸混合后溶液呈中性,则混合前a、b间的关系为 ;其他条件不变,温度变为100℃,则a、b间的关系又应为 。(已知100℃时Kw=1×10-12)
四、实验题
25.用中和滴定的方法测定NaOH和Na2CO3混合溶液中NaOH含量时,可先在20mL混合溶液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用0.1000mol/LHCl滴定(酚酞作指示剂,其变色范围是8-10)。试回答:
⑴向混有BaCO3沉淀的NaOH溶液中滴入盐酸,为什么不会使BaCO3溶解,而能测定NaOH的含量? 。
⑵滴定终点时溶液颜色如何变化? 。
⑶已知甲基橙的变色范围为3.1-4.4。若用甲基橙作指示剂,测出的NaOH的含量将比实际值 (选填“大”、“小”、“无影响”)
⑷滴定中应用 手控制滴定管活塞,眼睛注视 。
![]()
![]()
![]() ⑸若滴定前滴定管读数为0.00mL,滴定后液面如右图,
⑸若滴定前滴定管读数为0.00mL,滴定后液面如右图,
![]()
![]() 则此时消耗标准溶液的体积为
。
则此时消耗标准溶液的体积为
。
|
![]()
![]()
![]()
![]()
![]() ⑺下列哪些操作会使测定结果偏高
。
⑺下列哪些操作会使测定结果偏高
。
![]()
![]()
![]() ①锥形瓶用待装液润洗 ②滴定管用待装液润洗
①锥形瓶用待装液润洗 ②滴定管用待装液润洗
③滴定管尖端气泡未排除
④滴定前仰视滴定管读数,滴定后俯视滴定管读数
26.用实验确定醋酸是弱电解质。两同学的方案是:
甲:取0.1mol/L的醋酸置于小烧杯中,滴入石蕊试液,溶液呈红色,再加入醋 酸铵固体,搅拌,观察现象,即可证明醋酸是弱电解质。
乙:取0.1mol/L的醋酸溶液置于试管中,用pH试纸测出该溶液的pH,即可证明醋酸是弱电解质。
(1)两个方案中都要用到的玻璃仪器是 。
(2)甲方案中,说明醋酸是弱电解质的现象是 。
乙方案中,说明醋酸是弱电解质的理由是测得溶液的pH 1(选填>、<、=)。
(3)不用醋酸,另选药品,请你再提出一个比较容易进行的方案,作简明扼要表述。
。
五、计算题
27.将体积比为1:3的N2和H2的混合气体通入密闭容器中,在一定条件下发生反应,达到化学平衡时,混合气体中N2的体积分数为a%(a<25)。求:
①平衡混合气中NH3的体积分数
②平衡时气体的压强和反应前气体压强之比。
28.有硫酸和盐酸的混合溶液20mL,加入0.025mol/L的氢氧化钡溶液时,生成的沉淀质量m与加入的氢氧化钡的体积V的关系如图,c点时溶液的pH=7。求:
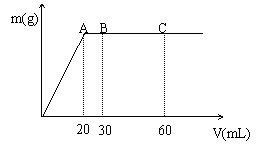 ①最初时硫酸及盐酸的物质的量浓度
①最初时硫酸及盐酸的物质的量浓度
②A、B点溶液的pH。
(两溶液混合时体积的变化可忽略不计)
(lg2=0.3, lg3=0.48, lg5=0.7)
| |
化 学 试 题 答 题 卷
班级 学号 姓名 成绩
一、二选择题(1-10小题,每小题只有1个选项符合题意,每小题2分,共20分。11-20小题,每小题有1-2个选项符合题意,每小题3分,共30分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
三、填空题
21.⑴① ②
⑵ ⑶
⑷ ⑸
⑹ 。
22.⑴ ⑵ ⑶ ⑷
23.⑴ ⑵ ⑶ ⑷
24.⑴
⑵ ; 。
四、实验题
25.⑴ ⑵ ⑶
⑷ , ⑸ ⑹ ⑺
26.⑴ ⑵ 。
⑶
。
27.
28.