高二电离平衡期中复习精选练习
1.下列各种离子,不能破坏水的电离平衡的是( )
A. 所有离子中半径最小的离子
B. 最外层电子排布和氖原子相同的+1阳离子
C. NaOH溶于水电离出的离子
D. NaHSO4溶于水电离出的离子
2.向纯水中加入少量NaHSO4晶体,若温度不变,则溶液中
A. 水电离出的H+大于水电离出的OH-浓度
B. c(H+).c(OH-)乘积增大
C. 酸性增强
D. OH-浓度减小
3.在一定温度下,冰醋酸加水稀过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
(1)“O”点导电能力为0的理由是
(2) a、b、c三点溶液中c(H+)由小到大的是
(3)a、b、c三点中电离程度最大的是
(4)若使c点溶液中c(CH3COO-)增大,溶液中c(H+)减小,可采取的措施是
① ②
4.取PH均为2的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03g锌粉在相同条件下充分反应,有关叙述正确的是( )
A. 醋酸和锌反应放出H2多
B. 盐酸和醋酸分别与锌反应,放出的H2一样多
C. 醋酸与锌反应速率快
D. 盐酸和醋酸分别与锌反应速率一样快
5.60mL0.5mol.L-1的NaOH溶液和40 mL0.4 mol.L-1H2SO4相混合后,溶液的PH约为
A.0.5 B.1.7 C. 2 D. 13.2
6.盐类水解的过程中正确的说法是
A.盐的电离平衡破坏 B.水的电离平衡发生移动
C.溶液的PH发生改变 D.没有发生中和反应
7.某溶液由水电离出的H+浓度为10-13 mol.L-1,则该溶液的PH可能是
A.13 B.1 C.6 D.7
8.下列离子既能电离又能水解,且能与强酸或强碱反应的是
A. CH3COO- B. HSO4- C.H2PO4- D.AlO2-
9.将pH相同的盐酸和醋酸溶液分别稀释到原体积的m倍和n倍,稀释后两溶液的PH相同中,则m和n的关系
A.m=n B.m>n C.m<n D.无法确定
10.将物质的量浓度相同的盐酸和醋酸溶液稀释到原体积的m倍和n倍,稀释后PH, 则m和n的关系
A.m=n B.m>n C.m<n D.无法确定
11.一定量的镁粉与稀硫酸反应,其速率特别快难以控制。为了能较缓慢收集到氢气,又使产生氢气的量不减少,应向稀硫酸中加入 理由是
12.NH4Cl溶液中,离子浓度由大到小顺序正确的是( )
A. c(NH4+)>c(Cl-)>c(H+)>c(OH-) B. c(Cl-)> c(NH4+)>c(H+)>c(OH-)
C. c(H+)>c(OH-)> c(NH4+)> c(Cl-) D. c(Cl-)> c(NH4+)> c(OH-)> c(H+)
13.25oC、0.1 mol.L-1的溶液:①NaOH②NH4Cl③HCl④Ba(OH)2⑤NaCO3⑥Na2SiO3⑦NaHCO3⑧H2SO4⑨(NH4)2SO4,pH由大到小的顺序是
14. 25oC,pH=2的酸(HA)溶液和pH=12的碱(BOH)溶液等体积混合,混合溶液,pH=5。
(1)混合溶液中 离子一定发生水解反应。
(2)在(1)中所指离子水解的离子方程式是
15.(1999年上海)在蒸发皿中加热蒸干并灼烧(低于400oC)下列物质的溶液,可以得该物质固体的是
A.氯化铝 B.碳酸氢钠 C.硫酸镁 D.高锰酸钾
16.(2002全国)将醋酸和氢化钠混合,所得溶液PH=7,则此溶液中
A. c(CH3COO-) >c(Na+) B. c(CH3COO-) <c(Na+)
C. c(CH3COO-) =c(Na+) D. 无法确定c(CH3COO-) 与c(Na+)的关系
17. (2000全国)室温下,在PH=12的某溶液中,由水电离的c(OH-)为
A1.0×10-7 mol.L-1 B. 1.0×10-6 mol.L-1
C. 1.0×10-2 mol.L-1 D. 1.0×10-12 mol.L-1
18.在水中加入下列物质,可使水的电离平衡向电离方向移动的是( )
A.H2SO4 B .KOH C.FeCl3 D.Ba(NO3)
19.把同物质的量浓度、同体积的氨水与盐酸混合,则混合溶液显 性,所得溶液中各离子浓度由大到小的顺序是 ;若把PH为12的氨水与PH为2的盐酸等体积混合,则混合溶液显 性,所得溶液中各离子浓度由大到小的顺序是
20.已知一种PH=3的酸溶液和一种PH=11的碱溶液等体积混合后溶液呈碱性其原因可能是( )
A. 稀的强酸溶液和浓的强碱溶液反应
B. 浓的弱碱溶液和稀的强酸溶液反应
C. 等浓度的强碱和弱酸溶液反应
D. 混合后生成了一种强碱弱酸盐
21.某Na2S溶液的PH与稀NaOH溶液的PH相同,其中由水电离出来的c(OH-)分别为xmol/L和ymol/L,则x和y的关系正确的是( )
A.x= B. x>y C. x<y D.无法确定
22.相同物质的量浓度的NH4HSO4和(NH4)2SO4溶液,都显 性。前者显此性的主要原因是 ;后者显此性的主要原因是
23.有100mLPH=12的NaOH溶液,要使它的PH降为11
A.如果加入蒸馏水,应加 mL
B.如果加入PH=10的氢氧化钠溶液,应加 mL
C.如果加入0.01mol/L盐酸,应加 mL
24.为了除去ZnCl2酸性溶液中的Fe3+离子, 可在加热搅拌的条件下,加入一种试剂,使溶液的PH升高,过滤后再加入适量盐酸即可,该试剂可以选用
A.碳酸钾 B 碳酸锌 C. 碳酸钠 D.硫酸镁
25.有两种PH都等于2的酸溶液,已知一种是强酸,另一种是弱酸,现只有石蕊试液、酚酞试液、PH试给和蒸馏水,而没有其他试剂,简述如何用最简便的方法来鉴别出哪瓶是强酸:
A. 所选用的试剂是
B. 采用的方法是
C. 所依据的原理是
26. 下列电离方程式中,正确的是
A.NaHCO3 溶于水:NaHCO3 ==Na+ + H+ + CO32-
B.(NH4)2SO4溶于水:(NH4)2SO4 == 2NH4+ + SO42-
C.NH3 溶于水:NH3·H2O NH4+ + OH-
D.CO2溶于水:H2CO3 2H+ + CO32-
27.(99年上海高考题)把0.05 mol NaOH (s) 分别加入100mL下列溶液中,溶液的导电能力变化最小的是
A.自来水 B. 0.5mol/L的盐酸
C.0.5mol/L的醋酸 D. 0.5mol/L的KCl溶液
28. (8分)现有如下六种物质:①Cl2 ②NO2 ③NH3 ④H2SO4 ⑤蔗糖 ⑥NaOH。用序号回答下列问题:
⑴. 水溶液能导电的有 ,
⑵. 熔化或液态能导电的有 ,
⑶. 属于非电解质的有 ,
⑷. 属于电解质的有 。
29. 10分)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的PH 7(填“大于”、“等于”、“小于”),原因是: ;实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于较浓的 中,后再用水稀释到所需的浓度,以
(填“促进”、“抑制”)其水解。
30. (10分)填空
(1)图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL, 如果刻度A为4,量简中液体的体积是 mL。
(2)图II表示50mL滴定管中液画的位置,
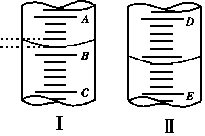 如果液面处的读数是a ,则滴定管中
如果液面处的读数是a ,则滴定管中
液体的体积(填代号)
(A) 是amL
(B) 是(50-a)mL
(C) 一定大于amL
(D) 一定大于(50-a)mL
(3)若图I表示50mL滴定管中液面的位置,A与C刻度间相差1mL, 如果刻度A为6,则液面读数为________mL。
31. 下列仪器中,刻度“0”在上端的是
A.量筒 B. 滴定管 C.温度计 D.容量瓶
答案
1B
2 CD
3.(1)在O点处醋酸未电离,无离子存大
(2)a<c<b
(3)c
4.B 5.B6.BC7.AB8.C9.C10.C
11.直接加水稀释或加弱酸强碱盐(如醋酸钠)
12.B13.4>1>6>5>7>2>9>3>8
14.A- A-+H2O=HA+OH
15.C16.C17.CD18.C19.酸;c(Cl-)> c(NH4+)>c(H+)>c(OH-)碱性c(NH4+)>c(Cl-)> c(OH-)> c(H+)20.B21.B22.硫酸氢根电离产生的H+ ;NH4+ 水解产生的
23.900;1000;81.8;24.BD
25.PH试纸蒸留水;取等体积的两种酸液加水稀释相同的倍数;强酸完电离,当稀释相同的倍数,强酸改变PH较大了