高二毕业会考化学模拟试题
所需相对原子质量: H—1 N—14 Cl—35.5
一、选择题(本题共25个小题,第1—10题,每题1分,第11—25题,每题2分。 每 小题只有一个选项符合题意。共40分)
1.常温下,不能与O2大量共存的气体是 ( )
A.CO B.N2 C.NO D.SO2
2.下列物质在通常状况下显无色的是 ( )
A.Na2O2 B.NH3 C.S D.Cl2
3.第三周期的非金属元素对应的含氧酸中,酸性最强的是 ( )
A.硫酸 B.磷酸 C.硅酸 D.高氯酸
4.下列各组物质中,互为同系物的是 ( )
A.白磷和红磷 B.乙烷和丁烷 C.1-丁烯和2-丁烯 D.![]() 和
和![]()
5.下列化合物中,只存在离子键的是 ( )
A.NaCl B. CO2 C.NaOH D.Na2O2
6.人们生活中使用的化纤地毯、三合板、油漆等化工产品,会释放出某种污染空气的气体,该气体是 ( )
A.甲醛 B.二氧化硫 C.甲烷 D.乙醇
7.与硝酸强氧化性有关的叙述是 ( )
A.应避光保存 B.浓硝酸通常呈黄色
C.能与碱反应 D.可与铜反应
8.氯气可用来消灭田鼠,为此将氯气通过软管灌入洞中,这是利用了氯气下列性质中的 ( )
①黄绿色 ②密度比空气大 ③有毒 ④较易液化 ⑤溶解于水
A.②③ B.③④ C.①②③ D.③④⑤
9.某金属元素R原子的质量数为55,已知R的离子含有30个中子,23个电子,由这种离子形成的化合物为 ( )
A.RO2 B.RSO4 C.Na2RO3 D.RCl
10.下列物质的溶液显碱性的是 ( )
A.KNO3 B.FeCl3 C.Na2CO3 D.Al2(SO4)3
11.在一定条件下,发生CO(g)+NO2(g)![]() CO2(g)+NO(g)(正反应为放热反应)的反应,达到平衡后,保持体积不变,降低温度,混合气体的颜色
CO2(g)+NO(g)(正反应为放热反应)的反应,达到平衡后,保持体积不变,降低温度,混合气体的颜色
( )
A.变深 B.变浅 C.不变 D.无法判断
12.把钠放入滴有石蕊的水中,下列现象不正确的是 ( )
A.钠浮在水面上 B.钠熔化成小球并在水面上迅速游动
C.钠表面有气泡放出 D.水溶液变为红色
13.过氧化氢(H2O2)被称为“绿色漂白剂”,关于H2O2的下列叙述中不正确的是( )
A.H2O2分子中含有O2-离子 B.H2O2将有可能替代“漂白粉”
C.H2O2是常用的医用清毒剂 D.H2O2既有氧化性,又有还原性
14.欲除去铁粉中混有的少量铝粉,应选用的试剂是 ( ) A.稀盐酸 B.稀硝酸 C.硫酸铜溶液 D.氢氧化钠溶液
15.物质的量浓度相同的NaCl、MgCl2、A1C13三种溶液,当溶液的体积比为3 :2 :1时,三种溶液中Cl- 的物质的量浓度之比为 ( )
A.1 :1 :1 B.1 :2 :3 C.3 :2 :1 D.3 :4 :3
16.随着核电荷数的递增,下列三个主族元素性质变化规律叙述错误的是 ( )
A.碱金属的金属性增强 B.卤素的非金属性减弱
C.氧族的气态氢化物稳定性增强 D.三个族的原子半径都增大
17.下列离子方程式中不正确的是 ( )
A.澄清的石灰水跟盐酸反应 H+ + OH- =H2O
B.钠和水反应
2Na + 2H2O =2Na+ + 2OH- +
H2↑
C.碘化钾溶液跟适量溴水反应 2I- + Br2 =I2 + 2Br-
D.氢氧化钡溶液与稀硫酸混合 Ba2+ + SO42—= BaSO4↓
18.铁和下列物质反应,其中铁能生成+3价化合物的是 ( )
①硫 ②氯气 ③稀硫酸 ④硝酸 ⑤硫酸铜溶液
A.②④ B.③④ C.③⑤ D.①③⑤
19.下列各组混合物不能用分液漏斗分离的是 ( )
A.硝基苯和水 B.苯和甲苯
C.溴苯和NaOH溶液 D.乙酸乙酯和水
20.白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成的
实验是 ( )
①检验自来水中是否含氯离子 ②鉴别食盐和小苏打
③蛋壳能否溶于酸 ④白酒中是否含甲醇
A.②③ B.①④ C.②④ D.③④
21.下列物质中,既能与稀硫酸反应,又能与氢氧化钾溶液反应的是 ( )
A.氧化钠 B.氧化铝 C.三氧化硫 D.二氧化碳
22.丙烯醛的结构简式为CH2=CH—CHO,结合所学知识推测该物质不能发生的反应是 ( )
A.加成反应 B.加聚反应 C.酯化反应 D.氧化反应
23.在同温同压下,相同体积的乙烷和一氧化氮不相同的是 ( )
A.物质的量 B.含有的原子数 C.质量 D.密度
24.下列说法正确的是 ( )
A.人造丝、蚕丝都是蛋白质
B.淀粉和油脂是天然高分子化合物,通常都是纯净物
C.误食重金属盐类时,可以喝大量牛奶、蛋清或豆浆解毒
D.福尔马林主要成分是甲酸,由于可使蛋白质变性,可用于保存动物标本
25.下列物质间能反应产生氢气,且产生H2速率最快的是 ( )
A.锌与2mol/LH2SO4 B.锌与3mol/LHCl
C.锌与6mol/LHNO3 D.锌与18mol/LH2SO4
二、填空题(本题包括6小题,共28分)
26.(3分)将氨气通入水中,存在的平衡体系为:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,则上述平衡体系中属于电解质的是
和
。属于非电解质的是 。
NH4++OH-,则上述平衡体系中属于电解质的是
和
。属于非电解质的是 。
27.(6分)在Al2(SO4)3溶液中加入少量的NaOH溶液,观察到的现象是
,将生成物分成两份,向第一份中加入过量的氢氧化钠溶液,向另一份中加入过量的稀硫酸,反应的离子方程式分别为_______ 、_________ ______________,
由此说明氢氧化铝是______________(填物质类别)。
28.(4分)现有A、B、C、D四种气体: ①A为黄绿色。②将A和D混合,混合气体在光照下发生爆炸反应生成物只有B。③C能使湿润的红色石蕊试纸变蓝且与B混合有大量白烟生成。
根据以上事实回答下列问题:
(1)B的电子式为 ,白烟的化学式为 ;
(2)将A通入水中发生反应的离子方程式为 。
29.(5分)甲元素的负一价离子的电子层结构与Ar相同,乙元素的正一价离子核外有10个电子。填写以下空白:
⑴甲、乙元素的形成化合物的电子式为 ,该化合物含有的化学键是 键。
⑵与乙元素同周期的元素中,原子半径最小的金属元素是 (填名称)。
⑶甲元素的单质和乙元素的最高氧化物水化物反应的化学方程式为:
。
![]() 30.(4分)根据下列各有机物回答问题(用编号填写)
30.(4分)根据下列各有机物回答问题(用编号填写)
![]() ①CH3CHO ② ③ ④CH3COOH
①CH3CHO ② ③ ④CH3COOH
⑴属于芳香烃的是 。
⑵能跟溴水反应生成白色沉淀的是 。
⑶能跟Na2CO3反应放出气体的是 。
⑷能发生银镜反应的是 。
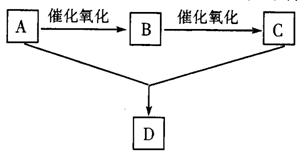 31.(6分)已知A是一种只含碳、氢、
氧三种元素的有机物,其蒸气的密度为相同条件下的氢气的密度的23倍。A可以和金属钠反应放出氢气并在一定条件下发生下图所示的变化。
31.(6分)已知A是一种只含碳、氢、
氧三种元素的有机物,其蒸气的密度为相同条件下的氢气的密度的23倍。A可以和金属钠反应放出氢气并在一定条件下发生下图所示的变化。
回答下列问题:
(1)A的结构简式为:
D的名称是
(2)写出反应的化学方程式:A→B
A+C→D
三、实验题(本题包括3小题,共20分)
32.(3分)指出使用下列仪器(已清洗干净)和用品的第一步操作:
(1)石蕊试纸(检验气体) ;(2)容量瓶 ;(3)集气瓶(收集NH3) 。
33.(9分)某溶液中含有SO42—、CO32—、OH—三种阴离子,如果只取一次溶液,分别将这三种离子于同一试管中检验出来。其操作的顺序是:(1)先加入 (填试剂名称,下同),若 (填现象,下同)可检验出
离子;(2)再加入 ,若 可检验出 离子;(3)最后加入 ,若 可检验出 离子。
34.(8分)实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计右图所示的实验以确认上述混合气体中有乙烯和二氧化硫。
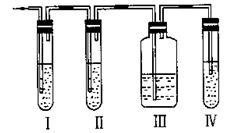 (1)I、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:
(1)I、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:
I ,Ⅱ ,Ⅲ ,Ⅳ
(将下列有关试剂的序号填入空格内)。
A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.酸性KMnO4溶液
(2)能说明二氧化硫气体存在的现象是
。
(3)使用装置Ⅱ的目的是 。
(4)使用装置Ⅲ的目的是 。
(5)确证含有乙烯的现象是 。
四、计算题(本题包括2小题,共12分)
35.(5分)将10.7g的氯化铵和足量的氢氧化钙固体粉末均匀混合,在加热条件下完全反应后可得标准状况下的氨气多少升? 若把产生的氨气全部溶解在30ml水 (水的密度为1g/cm3) 中,所溶液的密度为0.95g/cm3,则此溶液溶质的物质的量浓度是多少?(计算结果保留一位小数)
36.(7分)取标准状况下CH4和过量O2的混合气体840mL,点燃,将燃烧后的气体用过量碱石灰吸收,碱石灰增重0.600g。计算:
(1)碱石灰吸收后所剩气体的体积(标准状况下)。
(2)原混和气体中CH4跟O2的体积比。
参考答案
一、1.C 2.B 3.D 4.A 5.B 6.A 7.D 8.A 9.B 10.C 11.B 12.D 13.A 14.D 15.B 16.C 17.D 18.A 19.B 20.A 21.B 22.C 23.B
24.C 25.A
二、26.NH3·H2O H2O NH3
27.有白色沉淀生成 Al(OH)3 + OH - == AlO2 - + 2H2O
![]() Al(OH)3 +
3H+ == Al3+ + 3H2O 两性氢氧化物
Al(OH)3 +
3H+ == Al3+ + 3H2O 两性氢氧化物
28.(1)H NH4Cl (2)Cl2 + H2O == H+ + Cl - + HClO
![]() 29.⑴Na+[ ]— 离子 ⑵铝 ⑶Cl2 + 2NaOH == NaCl + NaClO+ H2O
29.⑴Na+[ ]— 离子 ⑵铝 ⑶Cl2 + 2NaOH == NaCl + NaClO+ H2O
![]() 30.⑴② ⑵③ ⑶④ ⑷①
30.⑴② ⑵③ ⑶④ ⑷①
31.(1)CH3CH2OH 乙酸乙酯 (2)2CH3CH2OH +O2 2CH3CHO + 2H2O
![]() CH3COOH + CH3CH2OH
CH3COOH + CH3CH2OH
![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
三、32.(1)用蒸馏水润湿 (2)检验是否漏液 (3)干燥
33.(1)酚酞 溶液呈红色 OH— (2)稀盐酸 有气泡产生 CO32—
(3)氯化钡溶液 有白色沉淀生成 SO42—
34.(1)A B A D (2)装置I中品红溶液褪色
(3)除去二氧化硫气体,以免干扰乙烯的检验 (4)检验二氧化硫是否除尽
(5)装置Ⅲ中的品红溶液不褪色,装置Ⅳ中的酸性高锰酸钾溶液褪色
四、35.4.48L 5.7mol/L
36.(1) 设原混合气体中CH4的物质的量为x。
根据CH4燃烧的化学方程式可知,1mol CH4完全燃烧得到的CO2和H2O共80g。
![]()
则 x=0.0075mol
CH4的体积为![]()
剩余气体的体积=![]()
(2)![]()