高二(文科)化学第一学期期中考试试卷2 2
说明:选择题答案填在试卷方框处,其他写在试题相应空格处,否则无效。
一、选择题(下列各题只有一个选项符合题意,每题2分,共44分)
1.曾对化学平衡进行研究并提出平衡移动原理的科学家是
A.勒夏特列 B.门捷列夫 C.道尔顿 D.拉瓦锡
2.某一反应物的浓度是1.0 mol/L经过2 s后,它的浓度变成了0.8 mol/L,在这2 s内它的反应速率为
A.0.2 mol/(L·s) B.0.1 mol/(L·s)
C.0.4 mol/(L·s) D.0.8 mol/(L·s)
3.在一定的条件下,对于密闭容器中进行的反应: P(g)+Q(g) ![]() R(g)+S(g)下列说法中可以充分说明这一反应已经达到化学平衡状态的是( )
R(g)+S(g)下列说法中可以充分说明这一反应已经达到化学平衡状态的是( )
A.P、Q、R、S的浓度相等
B.P、Q、R、S在密闭容器中共存
C.P、Q、R、S的浓度不再发生变化
D.用P的浓度表示的化学反应速率与用Q的浓度表示的化学反应速率相等
4.在强酸性溶液中能大量共存的无色透明的离子组为
A.K+、Na+、CO32—、NO3— B.NH4+、Al3+、SO42—、NO3—
C.NH4+、K+、MnO4—、SO42— D.Ba2+、Na+、NO3—、SO42—
5. 反应3A(g)+ B(g) ![]() C(g) + 2D(g),下列用不同物质表示的平均速率最快的是
C(g) + 2D(g),下列用不同物质表示的平均速率最快的是
A.v(A)= 0.04 mol/(L·min) B.v(B)= 0.02 mol/(L·min)
C.v(C)= 0.01 mol/(L·min) D.v(D)= 0.03 mol/(L·min)
6. 下列叙述正确的是( )
A.固体氯化钠不导电,所以氯化钠是非电解质
B.金属铜不是电解质,它属于非电解质
C.氯化氢的水溶液能导电,所以氯化氢是电解质
D.氨气溶与水能导电,所以氨气是电解质
7. 肯定不会使化学平衡发生移动的外界条件是
A.浓度 B.压强 C.温度 D.催化剂
8. 下列电离方程式中正确的是
A.NH3·H2O![]() NH4+ + OH- B.H2CO3 == 2H+
+ CO32-
NH4+ + OH- B.H2CO3 == 2H+
+ CO32-
C.NaHCO3 ![]() Na+ +H+ + CO32—
D.HI
Na+ +H+ + CO32—
D.HI![]() H+
+ I—
H+
+ I—
9. 可逆反应N2+3H2![]() 2NH3+Q在一定条件下达成平衡,能使反应速率加快,并且平衡向正反应方向移动,可采取的方法是
2NH3+Q在一定条件下达成平衡,能使反应速率加快,并且平衡向正反应方向移动,可采取的方法是
A.加入合适的催化剂 B.降低温度
C.移去一部分氨 D.增大压强
10. 下列各反应的化学方程式中,属于水解反应的是( )
A、H2O+H2O![]() H3O++OH- B、HCO3-+OH-
H3O++OH- B、HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
C、CO2+H2O![]() H2CO3
D、CO32-+H2O
H2CO3
D、CO32-+H2O
![]() HCO3-+OH-
HCO3-+OH-
11. 在HNO2溶液中存在如下平衡:HNO2 ![]() H++NO2-
,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是 ( )
H++NO2-
,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是 ( )
A.NaOH溶液 B.硫酸溶液 C.NaNO2溶液 D.NaHSO4溶液
12. 下列物质的水溶液,其pH值小于7的是
A. Na2CO3 B.NH4NO3 C.Na2SO4 D.KNO3
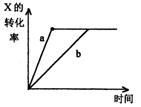 13. 如图,曲线a表示一定条件下,可逆反应X(g) + Y(g)
13. 如图,曲线a表示一定条件下,可逆反应X(g) + Y(g) ![]() 2Z(g) +W(s),正反应为放热反应的反应过程,若使a曲线变为b曲线,可采取的措施是
2Z(g) +W(s),正反应为放热反应的反应过程,若使a曲线变为b曲线,可采取的措施是
A.减小Y的浓度
B.增大Y的浓度
C.降低温度
D.减小反应体系的压强
14. 下列条件一定能使反应速率加快的是:①增加反应物的物质的量②升高温度③缩小反应容器的体积 ④加入生成物 ⑤加入MnO2 ( )
A.全部 B.①②⑤ C.② D.②③
15. 下列反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是
A.SO2(g) + NO2(g) ![]() SO3(g)
+ NO(g) (正反应为放热反应)
SO3(g)
+ NO(g) (正反应为放热反应)
B.C(s) + CO2(g) ![]() 2CO(g) (正反应为吸热反应)
2CO(g) (正反应为吸热反应)
C.4NH3(g) + 5O2(g) ![]() 4NO(g)
+ 6H2O(g) (正反应为放热反应)
4NO(g)
+ 6H2O(g) (正反应为放热反应)
D.H2S(g) ![]() H2(g)
+ S(s)
(正反应为吸热反应)
H2(g)
+ S(s)
(正反应为吸热反应)
16.将0.1 mol/L醋酸溶液加水稀释,下列说法正确的是( )
A.溶液中c(H+) 和c(OH-)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡左移 D.溶液pH增大
17.能证明甲酸是弱酸的事实是( )
A.能和碳酸钠反应生成二氧化碳
B.能溶解氢氧化铜沉淀生成蓝色溶液
C.与锌反应速度比硫酸慢
D.甲酸钠溶液的pH大于7
18.下列酸溶液的pH相同时,其物质的量浓度最小的是( )
A.H2SO3 B. H2SO4 C.CH3COOH D.HNO3
19.物质的量浓度和体积都相同的醋酸和硫酸,分别跟足量锌反应,在相同条件下,放出气体的体积为( )
A. 一样多 B.醋酸多 C.硫酸多 D.无法确定
20.把pH=3的硫酸溶液和pH=11的NaOH混合,溶液呈中性,则两种溶液的体积比应是( )
A.10:1 B.1:2 C.1:1 D.2:1
21.常温下,某溶液中水电离出的c(H+)=10-11mol/L,则该溶液不可能是( )
A.NaOH B.HCl C.CH3COOH D.NH4Cl
22.有一支50mL的酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度处,再加入一些溶液,此时读数可能为( )
A.11.0mL B.50.10mL C.0.1mL D.9.12mL
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
二、填空题
23.下列物质,能导电的是_____________,属于强电解质的是___________,属于非电解质的是_________________.
①铜②液氨③氯水④氯化钠⑤硫酸溶液⑥干冰⑦硫酸钡⑧液氧⑨金刚石⑩石墨
24.写出下列物质的电离方程式
KAl(SO4)2_____________________________
NH4HSO4________________________________
KHCO3_____________________________
H2S______________________________
25. AlCl3溶液显 __性,其水解的离子反应方程式为
在配制溶液时,应加入 ,以防止其水解;Na2S溶液显 性,其水解的离子反应方程式为 。配制时应加入 ,以防止其水解。
26. 在一定条件下,可逆反应:mA+nB![]() pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n____p。
(2)A、C是气体,增加B的量,平衡不移动,则B为_______态。
(3)加热后,可使C的质量增加,则正反应是______反应(放热或吸热)。
27. 将物质的量浓度均为0.1 mol·L-1的NH3·H2O、NH4Cl、KNO3、KOH、NaHCO3、H2SO4、CH3COOH溶液的pH按由大到小的顺序进行排列:
28. 某温度下,纯水中的[H+]约为1×10-6mol/L,则[OH-]约为___________
已知25℃的某溶液的[OH-]为1×10-3mol/L,该溶液的[H+]为_____________
29. 反应 A + 3B = 2C + 2D在四种不同情况下的反应速率分别为:
①v (A)=0.15 mol (L·s) -1 ②v (B)=0.6 mol (L·s) -1
③v (C)=0.4 mol (L·s) -1 ④v(D)=0.45mol (L·s) -1。
该反应进行的快慢顺序为
三、计算题
30. 在2L密闭容器中,充入1 mol N2和3mol H2,一定条件下发生合成氨反应,2min时达到平衡。测得平衡混合气中NH3的体积比为25%,求:
⑴ 2min内的v(H2)
⑵ N2的转化率
⑶ H2在平衡时的体积分数
⑷ 平衡时容器的压强与起始时压强之比