高二(上)化学期中试卷
第一卷
一.选择题(每小题只有一个选项, 3×20=60)
1. 常温下能盛放在铝制的容器里的物质是 ( )
A、浓![]() B、NaOH溶液 C、浓盐酸 D.
B、NaOH溶液 C、浓盐酸 D.![]() 溶液
溶液
2. 下列气体相遇不会产生白烟现象的是
A.NH3和HCl B.NH3和HNO3蒸汽 C.NH3和O2 D.NH3和HBr
3. 下列气体中不能做喷泉实验的是 ( )
A.NH3 B.SO3 C.HCl D.NO
![]() 4.反应A(气)+ 2B(气) 2C(气)达到平衡,改变下列条件只影响化学反应速率,而不影响化学平衡的是
4.反应A(气)+ 2B(气) 2C(气)达到平衡,改变下列条件只影响化学反应速率,而不影响化学平衡的是
A.催化剂 B.压强 C.浓度 D.温度
5. 在一大试管中装入10mL NO,倒立于水槽中,然后向其中慢慢地通入6mL O2 ,下面有关实验最终状态的描述中,正确的是 ( )
A.试管内气体呈红棕色 B.试管内气体无色,是NO
C.试管内气体无色,是O2 D.试管内液面下降
6.将硝酸分解的气体产物通入水中,充分作用后 ( )
A、放出NO2 B、放出NO C、放出O2 D、无气体放出
7、下列各微粒能大量共存的是 ( )
A、H+、![]() 、
、![]() 、
、![]() B、
B、![]() 、
、![]() 、
、![]() 、
、![]()
C、![]() 、
、![]() 、
、![]() 、
、![]() D、
D、![]() 、Cu2+、
、Cu2+、![]() 、
、![]()
8. 将铜粉放入稀硫酸中,加热无明显反应发生;但加入某盐后,发现铜粉质量逐渐减少,
该盐可能是( )
A.CuCl2 B.ZnSO4 C.KNO3 D.NaCl
9. 往浅绿色的![]() 溶液中逐渐加入稀
溶液中逐渐加入稀![]() ,溶液颜色的变化是( )
,溶液颜色的变化是( )
A、逐渐变浅 B、逐渐变棕黄色 C、逐渐加深 D、没有变化
10. 亚硝酸(HNO2)参加化学反应,既可作氧化剂,也可作还原剂,当它作为氧化剂时,可能生成的产物是( )
A、NH3 B、N2O5 C、N2O3 D、NO2
11. 同温同压下,将NO和O2两种气体的体积比按3∶1混合,则混合气体的平均相对分子质量最接近的数值是( )
A.40.7 B.46 C.30.5 D.44
12. 碘化磷(PH4I)是一种白色晶体,根据所学过的知识和原理判断下列关于PH4I的描述错误的是( )
A.它是离子晶体,受热不易分解,易溶于水
B .受热时可能生成有色气体
C.它能跟NaOH反应放出PH3气体
D.Zn3P2(鼠药)与水作用生成的气体用盐酸吸收可制得PH4Cl
![]() 13. 在密闭的容器中反应:2A+B 2C达到平衡后,增大压强时向生成C的方向移动,
13. 在密闭的容器中反应:2A+B 2C达到平衡后,增大压强时向生成C的方向移动,
对于A、B和C的状态的判断正确的是 ( )
A.A和B至少有一种是气体; B.B一定是气体.
C.如果C是气体,B
一定不是气体; D.如果C是气体,B不一定是气体
14. 在 将12.8gCu放入一定量的稀![]() 中,充分反应放出气体2.24L(标况),Cu有剩余,参加反应的硝酸的质量为
(
)
中,充分反应放出气体2.24L(标况),Cu有剩余,参加反应的硝酸的质量为
(
)
A、25.2g B、12.6g C、3.15g D、6.3g
![]() 15. 容积为2L的密闭容器中,有反应 :mA(g)
+ nB(g) pC(g) + qD(g),经过5
min达到平衡,此时A减少a
mol/L, B的平均反应速度VB=0.6a mol/(L·min),C增加2a
mol/L,这时增加系统压强,发现A与C的百分含量不变,则m:n:p:q为( ):
15. 容积为2L的密闭容器中,有反应 :mA(g)
+ nB(g) pC(g) + qD(g),经过5
min达到平衡,此时A减少a
mol/L, B的平均反应速度VB=0.6a mol/(L·min),C增加2a
mol/L,这时增加系统压强,发现A与C的百分含量不变,则m:n:p:q为( ):
A.3:1:2:2 B.1:3:2:2 C.1:3:2:1 D.1:1:1:1
![]() 16. 可逆反应mA(g) nB(g)+pC(s)+Q,温度和压强的变化对正逆反应速率的影响
16. 可逆反应mA(g) nB(g)+pC(s)+Q,温度和压强的变化对正逆反应速率的影响
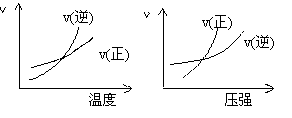 分别符合下图中的两个图象,
分别符合下图中的两个图象,
下列叙述中正确的是( )
A.m>n,Q>0
B.m>n+p,Q>0
C.m>n,Q<0
D.m<n+p,Q <0
17.下列事实,不能用勒夏特列原理解释的是 ( )
A.溴水中有下列平衡Br2+H2O ![]() HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g) ![]() H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2 ![]() CO2+NO(正反应为放热反应)升高温度可使平衡向逆反应方向移动
CO2+NO(正反应为放热反应)升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
18. 反应Fe+HNO3→Fe(NO3)3+H2O+ ,若铁跟起氧化作用的硝酸的物质的量之比为4:3,
则方框内的物质是( )
A、NO2 B、NO C、N2O D、N2
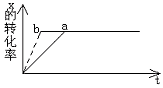 19. 图中,a曲线表示一定条件下可逆反应X(g)+Y(g)⇋2Z(g)+W(s)(正反应是放热反应)的反应过程。若使a曲线变
19. 图中,a曲线表示一定条件下可逆反应X(g)+Y(g)⇋2Z(g)+W(s)(正反应是放热反应)的反应过程。若使a曲线变
为b曲线,可采取措施是 ( )
A、升高温度 B、增大Y的浓度
C、降低温度 D、增大体系压强
20.将2 mol SO2和2 mol SO3气体,充入固定体积的密闭容器,在一定条件下发生
下列反应:2SO2+O2 ![]() 2SO3,平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时SO3的物质的量大于n mol的是
( )
2SO3,平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时SO3的物质的量大于n mol的是
( )
A.2 mol SO2+1mol O2 B.4 mol SO2+1mol O2
C.2 mol SO2+1mol O2 +2 mol SO3 D.3 mol SO2+1 mol SO3
第二卷
二.填空题(34分)
21.(10分) 现有固体试剂X:Zn粒、Cu粉、NaCl、MnO2;
酸或碱Y:浓H2SO4、浓HCl、氨水、NaOH固体;
盐溶液Z:AgNO3、KMnO4、KI、BaCl2;
选择上述试剂做以下实验,根据现象,将X、Y、Z的化学式填于空白处:
(1)试剂Y 与Y中另一试剂 混合,产生有刺激性气味气体 ,该气体极易溶于水,能使湿润的红色石蕊试纸变蓝。
(2)试剂X 和Y 共热,产生有刺激性气味的气体与沾有试剂Y 的玻璃棒靠近有大量白烟 生成。
(3)试剂Y 中加入X 共热,X溶解,溶液呈蓝色,并产生有刺激性气味气体,该气体通入紫色Z 溶液中,紫色褪去。
22.(12分)一定温度下反应:2NO2(g,红棕色)![]() N2O4(g,无色)达到平衡,如加压使体积缩小一半,可以观察到混合气体的红色先___________、后___________,表明平衡向________反应方向移动;如减压使体积增大一倍,可以观察到混合气体的红色先___________后___________,表明平衡________反应方向移动。
N2O4(g,无色)达到平衡,如加压使体积缩小一半,可以观察到混合气体的红色先___________、后___________,表明平衡向________反应方向移动;如减压使体积增大一倍,可以观察到混合气体的红色先___________后___________,表明平衡________反应方向移动。
23.(2分)将两种浓度都是1mol/L 的气体X2、Y2在密闭容器中反应生成Z,平衡时测得各物质的浓度是:c(X2)=0.58mol/L,c(Y2)=0.16mol/L, c(Z)=0.84mol/L,则Z的分子式为 。
24.(6分)今有甲,乙,丙三瓶等体积的新制氯水,浓度均为0.1mol/L。如果在甲瓶中加入少量的NaHCO3晶体,在乙瓶中加入少量的NaHSO3晶体,丙瓶不变。片刻后,甲乙丙三瓶溶液中HClO的物质的量浓度从大到小关系为(溶液的体积变化不计)_______________,理由是_______________。
25.(4分)配平下列反应的化学方程式并填空:
1) NH3 + O2![]() NO+ H2O,若有1.204×1024个电子发生转移,则被还原的物质的
NO+ H2O,若有1.204×1024个电子发生转移,则被还原的物质的
量是_______________mol。(2分)
2)在下列反应中, KNO2![]() K2O+ NO↑+ O2↑,当有22.4LNO(标况)生成
K2O+ NO↑+ O2↑,当有22.4LNO(标况)生成
时,则被氧化的氧原子的物质的量是_______________mol。(2分)
三、实验题(共12分)
26.下图为常用玻璃仪器组成的七种实验装置,根据需要可在其中加入液体或固体试剂。请选择适宜装置的序号填于空白处。
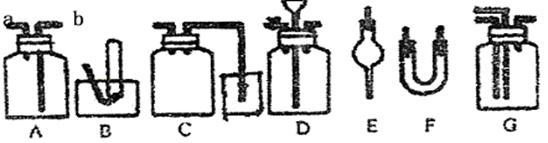
(1)既能用于收集Cl2,又能用于收集NO的装置是 ;
(2)A装置 口进气可收集密度比空气大的气体, 口进气时可收集密度小于空气的气体 ;
(3)在实验室制取Cl2并检验Cl2性质的连续实验中,用于除去Cl2中的HCl杂质的最佳装置是 ;
(4)合成氨实验中,可用于干燥、混合并能大致观察H2和N2的体积比的装置
是 ;
(5)用于尾气吸收并能防止液体倒吸到反应装置中的是 ;
(6)接在气体的连续实验中间,用于达到控制气流使其平稳目的的装置是 。
四.计算题(14分)
27.在一定条件下,某密闭容器中发生反应:2SO2 + O2![]() 2SO3 + Q , 反应达到平衡后,SO2,O2,SO3的物质的量之比为3:2:4。其他条件不变,升高温度,达到新的平衡时SO2=1.4mol, O2=0.9mol
2SO3 + Q , 反应达到平衡后,SO2,O2,SO3的物质的量之比为3:2:4。其他条件不变,升高温度,达到新的平衡时SO2=1.4mol, O2=0.9mol
求:(1)原平衡时三种物质的物质的量各为多少
(2)达新平衡后SO3的物质的量。
28. 在一定条件下,合成氨反应在2L密闭容器中进行,经5s后达到平衡,测得体系中NH3为4 mol,起始与平衡时的压强之比为13∶8,且CH2(始)∶CH2(平) ==4∶1,求:H2的反应速率及N2的转化率。
高二(上)化学期中试卷
命 题: 胡利平 审 题: 丁 胜。
一.选择题(每小题只有一个选项, 3×20=60)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
二.填空题(34分)
21.(1)
(2)
(3)
22.
23.
24.
25.(1) (2)
三、实验题(共12分)
26.(1) (2) (3)
(4) (5) (6)
四.计算题(14分)
27.
28