第四单元 电解原理及其应用
单元测试
(时间:90min 总分:110分)
一、选择题:每小题3分,共60分。
1.某氯碱厂不慎有大量氯气逸出周围空间,此时,可以用浸有某种物质的一定浓度的水溶液的毛巾捂住鼻子。最适宜采用的物质是 ( )
A.NaOH B.NaCl C.KBr D.Na2CO3
2.1L0.1mol/LAgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断正确的是(设电解按理论进行,溶液不蒸发) ( )
A.溶液的浓度变为0.08mol/L B.阳极上产生112mLO2(标准状况)
C.转移的电子数是1.204×1022个 D.反应中有0.01mol的Ag被氧化
3.用质量均为100g的铜做电极,电解AgNO3溶液,电解一段时间后,两电极的质量差为28g,则两电极的质量分别为 ( )
A.阳极100g,阴极128g B.阳极93.6g,阴极121.6g
C.阳极91.0g,阴极119.0g D.阳极86.0g,阴极114.0g
4.四个电解装置都以Pt做电极,它们分别装着如下电解质溶液进行电解,一段时间后,测定其pH值变化,所记录的结果正确的是 ( )
A B C D
电解质溶液 HCl AgNO3 BaCl2 KOH
pH值变化 减小 增大 不变 增大
5.电解硫酸溶液时,放出25mL(标况)O2,若以等量的电量在同样条件下电解盐酸溶液,所放出的气体的体积最接近下列数据中的 ( )
A.45mL B.50mL C.75mL D.100mL
6.用惰性电极电解pH==6的CuSO4溶液500mL,当电极上有16mg铜析出时,溶液的pH值约是(设电解前后溶液体积变化可以忽略,阴极上没有H2析出) ( )
A.1 B.3 C.6 D.9
7.用指定材料做阳极和阴极来电解一定浓度的溶液甲,然后加入物质乙能使溶液物质为甲溶液原来的浓度,则合适的组合是 ( )
阳极 阴极 溶液甲 物质乙
A.Pt Pt NaOH NaOH固体
B.Pt Pt H2SO4 H2O
C.C Pt NaCl 盐酸
D.粗铜 精铜 CuSO4 Cu(OH)2
8.如图所示,图中四种装置工作一段时间后,测得导线上均通过了0.002mol电子,此时溶液的pH值由小到大的排列顺序为(不考虑溶液的水解和溶液的体积变化)
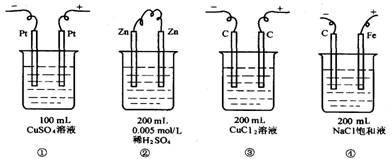
A.①<②<③<④ B.②<①<③<④ C.②<①<④<③ D.①<②<④<③
9.用惰性电极分别电解下列各物质水溶液一段时间后,向剩余电解质溶液中加入适量水能使溶液恢复到电解前浓度的是 ( )
A.AgNO3 B.Na2SO4 C.CuCl2 D.KCl
10.将两个铂电极插入500mLCuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064g(设电解时该电极无氢气析出,且不考虑水解和溶液体积的变化)。此时溶液中氢离子浓度约为 ( )
A.4×10-3mol·L-1 B.2×10-3mol·L-1
C.1×10-3mol·L-1 D.1×10-7mol·L-1
11.在25℃时,将两个铜电极插入一定量的硫酸钠饱和溶液中,进行电解,通电一段时间后,阴极逸出 amol气体,同时有wgNa2SO4·10H2O晶体析出,若温度不变,剩余溶液的质量分数是 ( )
A.×100% B.×100%
C.% D.%
12.X、Y、Z、M代表四种金属,金属X和Z用导线连接放人稀硫酸中时,X溶解,Z极上有氢气析出;若电解Y2+离子和Z2+离子共存的溶液时,Y先析出,又知M2+离子的氧化性强于Y2+离子。则这四种金属的活动性由强到弱的顺序为 ( )
A.X>Z>Y>M BX>Y>2>M C.MC>Z>X>Y D.X>Z>M>Y
13.目前,人们正在研究开发一种高能电池--钠硫电池,它是以熔融的钠、硫为两极,以Na+导电的S′-Al2O3陶瓷作固体电解质,反应式如下:
2Na+xS Na2Sx,以下说法正确的是 ( )
A.放电时,Na作正极,S作负极
B.充电时钠极与外电源的正极相连
C.若用此电极电解硝酸银溶液,当阳极上产生标准状况下气体1.12L时,消耗金属钠4.6g
D.充电时,阴极发生的反应为:Rx2--2e-== xS
14.用惰性电极电解VmL某二价金属的硫酸盐溶液一段时间后,阴极有wmg金属析出,溶液的pH从6.5变为2.0(体积变化可忽略不计)。析出金属的相对原子质量为 ( )
A.100w/V B.200w/V C.2×10-5w/V D.1×10-5w/V
15.以铁为阳极、以铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2molFe(OH)3沉淀,此间共消耗水的物质的量为 ( )
A.2mol B.3mol C.4mol D.5mol
16.在铁制品上镀一定厚度的锌层,以下方案设计正确的是 ( )
A.锌作阳极,铁作阴极,溶液中含有锌离子
B.铂作阴极,铁作阳极,溶液中含有锌离子
C.铁作阳极,铁作阴极,溶液含亚铁离子
D.锌作阴极,铁作阳极,溶液中含锌离子
17.实验室用铅蓄电池作电源电解饱和食盐水制取Cl2,已知铅蓄电池放电时发生如下反应:负极Pb+SO42-===PbSO4+2e- 正极PbO2+4H++SO42-+2e-===PbSO4+2H2O
今若制得Cl20.050mol,这时电池内消耗的H2SO4的物质的量至少是 ( )
A.0.025mol B.0.050mol C.0.10mol D.0.20mol
18.下列关于电解精炼铜的叙述中不正确的是 ( )
A.粗铜板体:阳极
B.电解时,阳极发生氧化反应,而阴极发生的反应为Cu2++2e-=Cu
C.粗铜中所含Na、Fe、Zn等杂质,电解后以单质形式沉积槽底,形成阳极泥
D.电解铜的纯度可达99.95%~99.98%
19.下列过程①电离②电解③电镀④电泳⑤电化腐蚀,需通电后才可进行的是 ( )
A.①②③ B.②③④ C.③④⑤ D.①②③④⑤
20.将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比是 ( )
A.1:2:3 13.3:2:1 C.6:3:1 D.6:3:2
第四单元 电解原理及其应用
单元测试
____班学生_________得分 _________
一题答题表
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
二、填空题:包括3个小题,共31分。
21.(9分)图中每一方框中的字母代表一种反应物或生成物:
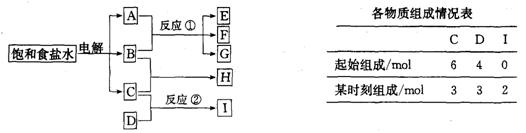
 物质A跟B反应生成E、F和G,物质C跟D反应生成I,某温度下该反应起始和某时刻的反应混合物组成如上表,请填写下列空白:
物质A跟B反应生成E、F和G,物质C跟D反应生成I,某温度下该反应起始和某时刻的反应混合物组成如上表,请填写下列空白:
(1)物质H的分子式是_________________
(2)反应①的化学方程式是_____________________________________________。
(3)反应②的化学方程式(须注明反应条件)是________________________________。
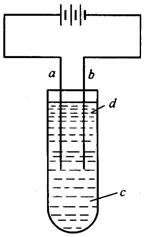
22.(14分)由于Fe(OH)2极易被氧化,所以实验很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。
(1)a电极材料应为________,电极反应式为_________________________。
(2)电解液c可以是(填编号)__________________。
A.纯水 B.NaCl溶液
C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为_________________,在加入苯之前对c应做何简单处理?_____________________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)_________
A.改用稀硫酸作电解液 B.适当增大电源的电压
C.适当减小两电极间距离 D.适当降低电解液的温度
(5)若c为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为
____________________________________________。
23.(8分)在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量的问题。解决方法之一是把这些陶土和水一起搅拌,使微粒直径在10-9m~10-7m之间,然后插入两根电极,接通直流电源,这时阳极聚集________,阴极聚集_______,理由是_______________________________________________________________________。
三、计算题:包括2个小题,共19分。
24.(12分)(1)当电源通过2L6%的KOH溶液(ρ==1.05g/mL)时,溶液的浓度改变了2%,此时阳极析出的物质是什么?质量为多少克?
(2)若电解后溶液不小心混入KCl杂质,为了除去杂质又进行电解,当有5.6L(标态)Cl2析出,可认为电解作用是完全的,求最后所得溶液中KOH的质量分数为多少?
25.(7分)两根镍棒分别与电源正负极相连,并都插入NiSO4溶液中。若电流强度为I,通电时间为ts,结果阳极失重mg。已知每个电子的电量为1.6×10-19C,则可推知阿伏加德罗常数为多少?
第4单元测试答案
1.D 分析:物质的选取一要考虑能否和Cl2反应,二要考虑其本身或反应产物对人的健康的影响
2.C 分析:阳极:Ag+ + e- === Ag
1mol 1mol 108g
0.02mol 0.02mol 2.16g
(D错)
阳极;Ag—e-=== Ag+ (B错)
转移的电子数为:N==0.02×6.02×1023=1.204×1022(个) (C对)
电解后溶液中溶质为AgNO3,浓度不变(A错)
3.B分析:阴极反应:ZAg+ + 2e-=2Ag
xmol xmol
阳极反应;Cu - 2e- = Cu2+
mol xmol
经分析:两电极的质量差为阴极析出的Ag和阳极溶解的Cu的质量之和:即108x +64 · ==28 x==0.2 即m析出的Ag=108×0.2=21.6g m溶解的Cu=0.1×64=6.4g
则阳极:100—6.4=93.6g 阴极:100+21.6=121.6
4.D 5.D 6.B 7.B 8.A 9.B 10.A 11.D 12.A 13.C 14.B
15.D分析:电解时:阳极:Fe-2e-=Fe2+ 阴极:2H+ +2e-==H2
总电解方程式为:Fe+2H2O===Fe(OH)2+H2↑
4Fe(OH)2+O2+2H2O==4Fe(OH)3
则得关系式 8H2O ~ 4Fe(OH)2 2H2O~4Fe(OH)3
消耗水量和Fe(OH)3的关系式为:
10H2O ~ 4Fe(OH)3
5mol 2mol
16.A 电镀时,应用电解原理,镀件作阴极,要镀的金属作阳极,电镀液一般是要镀金属的盐溶液
17.A
18.C 分析:电解精炼铜,应用粗铜板体作阳极
发生反应:Cu-2e-= Cu2+,同时粗铜中所含Na,Fe、Zn等杂质也失电子,以离子形式溶解于电解液中
19.B 20.D
21.(1)HCl (2)Cl2 +2NaOH===NaCl+NaClO+H2O(3)N2+3H2![]() 2NH3
2NH3
22.(1)Fe;Fe-2e-===Fe2+ (2) BC (3)隔绝空气,防止Fe(OH)2被空气氧化;加热一段时间 (4) BC (5) 白色沉淀迅速变为灰绿色,最终变为红褐色。
23.带负电荷的胶体微粒陶土;带正电荷的氧化铁胶体微粒,带相反电荷的胶体微粒通电时产生电泳现象,分别向两极移动,从而达到除杂目的。
24.(1)阳极析出的物质是:O2
解:m (KOH)==2×1.05×1000×0.06=126(g) m[KOH(aq)]=== ==1575g
电解水的质量为:2×1.05×1000 —1575=525g
m(O2)== ×525 == 466.7g
(2)混入KCl杂质后,首先电解KCl溶液得:===0.25molCl2,设增加的KOH和溶液质量分别为x、y。
2KCl + 2H2O ![]() 2KOH + Cl2↑ + H2↑ △m
2KOH + Cl2↑ + H2↑ △m
2×39 2×56 1mol 2g 2×39—2=76g
x 0.25mol y
解得x=28(g) y==19(g) 故:w(KOH)=×100%==9.66%
25.解;由电极反应式:Ni - 2e- = Ni2+
58.69g 2mol
m(g) ![]() mol
mol
得NA=58.69It/(3.2×10-19m)