第一章 原子结构与性质
第一节 原子结构
【课内巩固】第一课时(原子的诞生,能层与能级,)
一、 选择题
1.下列说法中正确的是( )
A 所有的电子在同一区域里运动
B 能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动
C 处于最低能量的原子叫基态原子
D 同一原子中,1s、2s、3s所能容纳的电子数越来越多
2.道尔顿的原子学说曾经起了很大的作用。他的学说中主要有下列三个论点:①原子是不能再分的微粒;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球体。从现代原子——分子学说的观点看,你认为不正确的是( )
A 只有① B 只有② C 只有③ D ①②③
3.下列关于原子的叙述正确的是( )
A ![]() 表示氢原子核的质子数是1,中子数也是1。
表示氢原子核的质子数是1,中子数也是1。
B ![]() 表示碳的一种同位素原子中含有7个质子和7个中子。
表示碳的一种同位素原子中含有7个质子和7个中子。
C ![]() 表示该微粒的质量数为19,电子数为9。
表示该微粒的质量数为19,电子数为9。
D ![]() 表示两种原子含有相同的中子数。
表示两种原子含有相同的中子数。
4.下列能级中轨道数为5的是( )
A S能级
B P能级
C d能级
D f能级
二、 填空题
5.在同一个原子中,离核越近、n越小的电子层能量
。在同一电子层中,各亚层的能量按s、p、d、f的次序
。
6.原子核外电子的每个能层最多可容纳的电子数与能层的序数(n)间存在关系是
7.理论研究证明,多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成能级,第三能层有3个能级分别为 。
【课外提升】
一、 选择题
1.在第n电子层中,当它作为原子的最外层时容纳电子数最多与第(n-1)层相同; 当它作为原子的次外层时,其电子数比(n-1)层多10个,则对此电子层的判断正确的是( )
A 必为K层
B 只能是L层
C 只能是M层
D 可以是任意层
2.氢原子的3d和4s能级的能量高低是 ( ![]() )
)
A 3d>4s
B 3d<4s
C 3d=4s
D 无3d,4s轨道,无所谓能量高低
二填空题
3.在1911年前后,新西兰出生的物理学家卢瑟福把一束变速运动的α粒子(质量数为4的带2个正电荷的质子粒)射向一片极薄的金箔,他惊奇地发现,过去一直认为原子是“实心球”,而这种“实心球”紧密排列而成的金箔,竟为大多数α粒子畅通无阻的通过,就像金箔不在那儿似的,但也有极少数的。粒子发生偏转,或被笔直地弹回。根据以上实验现象能得出关于金箔中Au原子结构的一些结论,试写出其中的三点
①__________________________________________________
②__________________________________________________
③_________________________________________________
4.在多电子的原子里的各个电子之间存在相互作用,研究某个外层电子的运动状态时,必须同时考虑到核及其他电子对它的作用。由于其他电子的存在,往往减弱了原子核对外层电子的作用力,从而使多电子原子的电子能级产生 现象。
【高考链接】
一、 往年高考
(2002年,全国)目前普遍认为,质子和中子都是由被称为u夸克和d夸克的两类夸克组成。u夸克带电量为![]() e,d夸克带电量为
e,d夸克带电量为![]() e,,e为基元电荷。下列结论中可能正确的是( )
e,,e为基元电荷。下列结论中可能正确的是( )
A 质子由1个u夸克和2个d夸克组成,中子由1个u夸克和2个d夸克组成
B 质子由2个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成
C 质子由1个u夸克和2个d夸克组成,中子由2个u夸克和1个d夸克组成
D 质子由2个u夸克和1个d夸克组成,中子由1个u夸克和1个d夸克组成
二、高考模拟题
已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号和该原子的电子分布在几个不同的能层上:
X_____ __ __ Y____ _____
Z___ _ _____ W____ _____
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为________________________ ______。E在催化剂存在的条件下可用于还原汽车尾气中的______,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为___________ __________________ __________
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序)为 ,该化合物的水溶液与足量NaOH溶液反应的化学方程式为 ____________ __ __
【课内巩固】第二课时(构造原理,能量最低原理、基态与激发态、光谱)
一、选择题
1.一个电子排布为1s22s22p63s23p1的元素最可能的价态是( )
A +1
B +2
C +3
D -1
2.下列各原子或离子的电子排布式错误的是( )
A Al 1s22s22p63s23p1
B O2- 1s22s22p6
C Na+ 1s22s22p6
D Si 1s22s22p2
3.下列表达方式错误的是( )
A 甲烷的电子式 ![]()
B 氟化钠的电子式 ![]()
C 硫离子的核外电子排布式 1s22s22p63s23p4
D 碳-12原子 ![]() C
C
4.Pb2+离子的价电子结构是( )
A 5S2
B 6S26P2
C 5S25P2
D 5S25P25d106S2
二、填空题
5.现在物质结构理论原理证实,原子的电子排步遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做 原子。
6.不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的 ,总称原子光谱。
7.根据下面构造原理写出11、16、35号元素的基态的电子排布式 ;
; 。
 构造原理
构造原理
【课外提升】
一、 选择题
1.列离子中外层d轨道达半充满状态的是 ( ![]() )
)
A Cr3+
B Fe3+
C Co3+
D Cu+
2.在多电子原子中,轨道能量是由( )决定的。
A n(主量子数)
B n和l
C n ,l ,m
D n和m
二填空题
3.按所示格式填写下表:
| 原子序数 | 电子排布式 | 价层电子排布 | 周期 | 族 |
| 49 | ||||
| 1s22s22p6 | ||||
| 3d54s1 | ||||
| 6 | ⅡB |
4.某元素的激发态原子的电子排布式为1s![]() 2s
2s![]() 2p
2p![]() 3s
3s![]() 3p
3p![]() 4s
4s![]() ,则该元素基态原子的电子排布式为
;元素符合为
。
,则该元素基态原子的电子排布式为
;元素符合为
。
【高考链接】
一、 往年高考
(2000年上海)具有下列电子排布式的原子中,半径最大的是( )
A ls22s22p63s23p?
B 1s22s22p3
C 1s22s2sp2
D 1s22s22p63s23p4
二、高考模拟题
现有x、y、z三种元素的原子,电子最后排布在相同的能级组上,而且y的核电荷比x大12个单位,z的质子数比y多4个。1摩尔的x同酸反应能置换出1克氢气,这时x转化为具有氩原子型电子层结构的离子。
(1)判断x、y、z各为何种元素?
(2)写出x原子、y的阳离子、z的阴离子的电子排布式。
【课内巩固】第三课时(电子云与原子轨道)
一、 选择题
1.对原子核外电子以及电子的运动,下列描述正确的是 ①可以测定某一时刻电子所处的位置②电子质量很小且带负电荷③运动的空间范围很小④高速运动 ⑤有固定的运动轨道⑥电子的质量约为氢离子质量的1/1836( )
A ①②③
B ②③④⑥
C ③④⑤⑥
D ⑤⑥
2.第七周期为不完全周期,若将来的发现可把这一周斯元素排满,则下列有关第七周期元素的推论可能是错误的是( )
A 第七周期排满时,最后一种元素的单质将很稳定
B 第七周期排满时,应该有32种元素
C 第七周期ⅡA族元素的氢氧化物性质与Al(OH)3相似
D 第七周期最后一种元素的原子序数为118
3.下列有关电子云及示意图的说法正确的是( )
A 电子云是笼罩在原子核外的云雾
B 小黑点多的区域表示电子多
C 小黑点疏的区域表示电子出现的机会少
D 电子云是用高速照相机拍摄的照片
4.下列叙述正确的是( )
A 同周期元素中,ⅦA族元素的原子半径最大
B ⅦA族元素的原子,其半径越大,越容易得到电子
C 室温时,零族元素的单质都是气体
D 所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等
二、填空题
5.量子力学告诉我们:ns能级各有 个轨道,np能级各有 个轨道,nd能级各有 个轨道,nf能级各有 个轨道。每个原子轨道里最多只能容纳 个电子,而且自旋方向相反。
6.人们把电子云轮廓图称为原子轨道,S电子的原子轨道都是 形的,P电子的原子轨道都是 形的,每个P能级有3个原子轨道,它们相互垂直,分别以 为符合。
7.当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则被称为 。
【课外提升】
一、 选择题
1.下面哪一种说法最符合鲍里原理?( )
A 需要用四个不同的量子数来描述原子中的每一个电子
B 在原子中,具有一组相同的量子数的电子不能多于一个
C 充满一个电子壳层需要8个电子
D 电子必须沿着椭圆轨道运动
2.氢原子中 3s,3p,3d,4s轨道能量高低的情况为 ( ![]() )
)
A 3s<3p<3d<4s
B 3s<3p<4s<3d
C 3s=3p=3d=4s
D 3s=3p=3d<4s
二填空题
 3.A、B、C三种短周期元素,它们在周期表中的位置如图:
3.A、B、C三种短周期元素,它们在周期表中的位置如图:
A原子核内质子数和中子数相等。B、C两元素原子核外电子数之和是
A原子质量数的2倍。则:
(1)元素名称为A 、B 、C 。
(2)B和C最高价氧化物的水化物的化学式是 、 。
4.(1)R、M均为IA族元素,R、M所在周期的元素种类分别为n和m。若R的原子序数为x,当M在R的下一周期时,M的原子序数为 ;当M在R的上一周期时,M的原子序数为 。
(2)R、M均为ⅦA族元素,R、M所在周期的元素种类数分别为n和m。若R的原子序数为x,当M在R的下一周期时,M的原子序数为 ;当M在R的上一周期时,M的原子序数为 。
【高考链接】
一、 往年高考
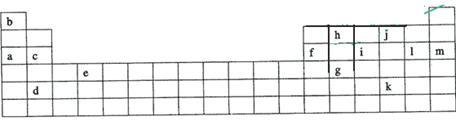
(04年上海)右表是元素周期表的一部分。
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是 ,其单质的电子式为 。
(3)俗称为“矾”的一类化合物通常含有共同的元素是
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
二、高考模拟题
大气中含有12C和14C,14C的半衰期为5730年,由于宇宙线的作用,大气中14C与12C的含量比基本不变。活的动植物体内14C与12C的含量比与大气的相同。当它们死后,由于14C的![]() 衰变,14C与12C的含量不 断减少。通过测量出土动植物残骸中14C与12C的含量比,可根据公式P=2-t/5730定出动植物死亡的年代,其中t是从动植物死亡到测量时的时间间隔,单位为年,P是出土植物残骸中14C与12C的含量比与现在大气中14C与12C的含量的比值。最近国际著名杂志《自然》报道了河南省出土的世界上最早的乐器——骨头做的笛子,测得骨笛的P值在33.7%和35.3%之间。
衰变,14C与12C的含量不 断减少。通过测量出土动植物残骸中14C与12C的含量比,可根据公式P=2-t/5730定出动植物死亡的年代,其中t是从动植物死亡到测量时的时间间隔,单位为年,P是出土植物残骸中14C与12C的含量比与现在大气中14C与12C的含量的比值。最近国际著名杂志《自然》报道了河南省出土的世界上最早的乐器——骨头做的笛子,测得骨笛的P值在33.7%和35.3%之间。
(1) 14C元素属第_____周期,第_____族,14C原子中有_____个中子,有_____个价电子。
(2) 这些骨笛大约是在_____年前制造的。
(3) 这些骨笛的制造年代属于下列中国历史的哪个文化时期 ( )。
A. 旧石器时代 B. 新石器时代 C. 青铜时代 D. 铁石器时代
(4) 吹奏骨笛能发声靠的是_____的振动。
(5) 骨笛是一种在顶端吹奏的竖笛。吹奏时,用手指封住笛孔、通过打开某个笛孔可以产生所需要的声音。声波的波 长等于打开笛孔到顶端的距离的四倍。设一笛孔到顶端的距离为20cm。求出相应的声波的频率(已知声速![]() )提示0.337≈2-1.57,0.355≈2-1.50。
)提示0.337≈2-1.57,0.355≈2-1.50。
第二节 原子结构与元素性质
【课内巩固】第一课时(原子结构与元素周期表)
一、选择题
1.外围电子构型为4f75d16s2元素在周期表中的位置是 ( ![]() )
)
A 四周期ⅦB族
B 五周期ⅢB族
C 六周期ⅦB族
D 六周期ⅢB族
2. 原子序数小于18的八种连号元素,它们单质的熔点随原子序数增大而变化的趋势如图所示。图中X元素应属( )
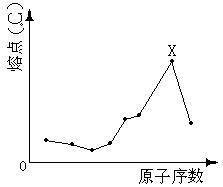
A ⅢA族
B ⅣA族
C ⅤA族
D ⅥA族
3.某周期ⅡA族元素的原子序数为x,则同周期的Ⅲ族元素的原子序数是( )
A 只有x+1
B 可能是x+8或x+18
C 可能是x+2
D 可能是x+1或x+11或x+25
4.下列各组元素性质递变情况错误的是( )
A Li、Be、B原子最外层电子数依次增多
B P、S、Cl元素最高正化合价依次升高
C N、O、F原子半径依次增大
D Na、K、Rb的金属性依次增强
二、填空题
5.元素的分区和族
1) s 区: ![]() , 最后的电子填在
上, 包括
, 属于活泼金属, 为碱金属和碱土金属;
, 最后的电子填在
上, 包括
, 属于活泼金属, 为碱金属和碱土金属;
2) p区:![]() , 最后的电子填在
上, 包括
族元素, 为非金属和少数金属;
, 最后的电子填在
上, 包括
族元素, 为非金属和少数金属;
3) d区: ![]() , 最后的电子填在
上, 包括
族元素, 为过渡金属;
, 最后的电子填在
上, 包括
族元素, 为过渡金属;
4) ds区: ![]() ,
(n-1)d全充满, 最后的电子填在
上, 包括 , 过渡金属(d和ds区金属合起来,为过渡金属);
,
(n-1)d全充满, 最后的电子填在
上, 包括 , 过渡金属(d和ds区金属合起来,为过渡金属);
5) f区: ![]() , 包括
元素, 称为内过渡元素或内过渡系.
, 包括
元素, 称为内过渡元素或内过渡系.
6. 判断半径大小并说明原因:
1)Sr 与Ba
2)Ca 与Sc
7.周期表中最活泼的金属为 ,最活泼的非金属为 ;原子序数最小的放射性元素为第 周期元素,其元素符号为 。
【课外提升】
一、 选择题
1.镭是元素周期表中第七周期的ⅡA族元素。下面关于镭的性质的描述中不正确的是( )
A 在化合物中呈+2价
B 单质使水分解、放出氢气
C 氢氧化物呈两性
D 碳酸盐难溶于水
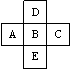 2.在元素周期表中前四周期的五种元素的位置关系如图示,若B元素
2.在元素周期表中前四周期的五种元素的位置关系如图示,若B元素
的核电荷数为Z,则五种元素的核电荷数之和可能为( )
A 5Z
B 5Z+18
C 5Z+10
D 5Z+8
二填空题
3.看表填空。
|
素 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | (1) |
| (2) | |||||
| 2 | (3) | (4) | (5) | (6) | ||||
| 3 | (7) | (8) | (9) | (10) |
(A)写出(1)-(10)号元素的元素符号:(1)______(2)_____(3)______(4)______(5)______(6)______(7)_______(8)______(9)________(10)______。并指出能成共价键的元素有______种。
(B)(1)、(5)、(9)号元素,相互化合时可形成_______化合物,但溶于水后也可以电离出_______离子和_______离子。
(C)(8)、(10)号元素化合时,可通过_______形成_______化合物。
(D)(1)、(5)、(7)号元素相互化合形成的物质中,既有_______键,又有_______键,它的俗称有_______、_______、_______。
(E)可形成双原子分子的单质有(写化学式):_______、_______、_______、________、_______,原子间以________键结合。
(F)可形成最稳定气态氢化物的元素是________。
(G)(1)、(4)号元素形成的气态氢化物溶于水后,溶液呈_______性,(1)、(10)号元素形成的气态氢化物溶于水后溶液呈_______性。
(H)(3)、(5)、(7)号元素相互化合可形成_______化合物。该物质俗称为_______,但属于_______类物质。
(I)分子中含有18个电子的气态氢化物有____种,分别写出化学式________,将分子中含10个电子的气态氢化物的化学式分别写出:_____、_____、______、_______。
(J)含氧量最高的离子化合物和共价化合物分别是(填化学式)_______和________。
(K)10种元素中化学性质最不活泼的是________。
(L)(3)、(7)、(9)三种元素的最高氧化物的水化物中,碱性由强到弱的顺序是________。
4.超重元素的假说预言自然界中可存在原子序数为114号的稳定同位素![]() X,试根据原子结构理论和元素周期律预测:
X,试根据原子结构理论和元素周期律预测:
(1)114X元素位于元素周期表第_____周期______族,为______元素(金属、非金属)。
(2)写出该元素最高价氧化物及其对应水化物的分子式______、______,并估计后者为_____性(酸、两性、碱)
(3)该元素与氯生成化合物的分子式_____、______。
【高考链接】
一、 往年高考
(05年上海)(A)
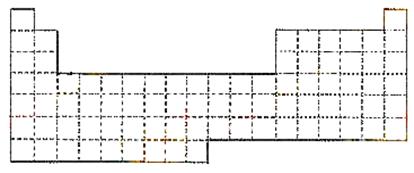
⑴ 在上面元素周期表中画出金属元素与非金属元素的分界线
⑵ 根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的
绝对值相等,又可把氢元素放在周期表中的____________族。
⑶ 现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应为黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 甲元素与硫元素相比较,非金属性较强的是______________(填名称),
写出可以验证该结论的一个化学反应方程式___________________________________。
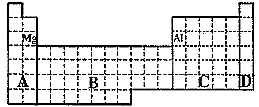
(B)

⑴ 在上面元素周期表中全部是金属元素的区域为___________。
(a)A (b)B
(c)C (d)D
⑵ 有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是______________。
⑶ 现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 甲、乙两元素相比较,金属性较强的是______________(填名称),
可以验证该结论的实验是_____________________________。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
二、高考模拟题
下表是元素周期表的一部分,回答有关问题
|
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 |
|
|
|
| ① |
| ② |
|
| 3 | ③ | ④ | ⑤ | ⑥ |
| ⑦ | ⑧ | ⑨ |
| 4 | ⑩ |
|
|
|
|
|
|
|
![]()
![]() (1) 写出下列元素符号①_____⑥_____⑦_____ _____;
(1) 写出下列元素符号①_____⑥_____⑦_____ _____;
(2) 在这些元素中,最活泼的金属元素是_____,最活泼的非金属元素是_____,最不活泼的元素是______;
(3) 在这些元素的最高价氧化物对应的水化物中,酸性最强的是_____,碱性最强的是_____,呈两性的氢氧化物是_____,写出三者之间相互反应的化学方程式_____;
![]() (4) 在这些元素中,原子半径最大的是_____,原子半径最小的是_____;
(4) 在这些元素中,原子半径最大的是_____,原子半径最小的是_____;
(5) 在③与④中,化学性质较活泼的是_____,怎样用化学实验证明?在⑧与 中,化学性质较活泼的是_____,怎样用化学实验证明?
【课内巩固】第二课时(元素周期律:原子半径,电离能,电负性)
一、 选择题
1.下列元素中哪一个基态原子的第一电离能最大?( )
A Be
B B
C C
D N
2.在下面的电子结构中,第一电离能最小的原子可能是 ( ![]() )
)
A ns2np3
B ns2np5
C ns2np4
D ns2np6
3.下列各组微粒按半径逐渐增大,还原性逐渐增强的顺序排列的是( )
A Na、K、Rb
B F、Cl、Br
C Mg2+、Al2+、Zn2+
D Cl-、Br-、I-
4、已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A X与Y形成化合物是,X可以显负价,Y显正价
B 第一电离能可能Y小于X
C 最高价含氧酸的酸性:X对应的酸性弱于于Y对应的
D 气态氢化物的稳定性:HmY小于HmX
二、 填空题
5. 原子半径的大小取决于二个相反因素:一是 ,另一个因素是 。
6. 周期表从左到右,元素的电负性逐渐变大,周期表从上到下,元素的电负性逐渐 。电负性的大小也可以作为判断金属性和非金属性强弱的尺度。
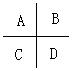
7.除去气态原子中的一个电子使之成为气态+1价阳离子时所需外界提供的能量叫做该元素的第一电离能。图是周期表中短周期的一部分,其中第一电离能最小的元素是________.
【课外提升】
一、 选择题
1.元素周期表第二周期Li到Ne原子的电离势总的趋势是怎样变化的( )
A 从大变小
B 从小变大
C 从Li到N逐渐增加,从N到Ne逐渐下降
D 没有多大变化
2.下列第三周期元素的离子中,半径最大的是 (
![]() )
)
A Na+
B Al3+
C S2-
D Cl-
二填空题
3. 将下列原子按电负性降低的次序排列,并解释理由:
As、F、S、Ca、Zn
4.比较硼、氮、氧第一电离能大小,并说明理由。
【高考链接】
一、 往年高考
(03年上海)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
|
(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚面离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
1.原子核对核外电子的吸引力 2.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(KJ·mol-):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。
②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的化学式 。
③Y是周期表中 族元素。
④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
二、高考模拟题
设想你去外星球做了一次科学考察,采集了该星球上十种元素单质的样品,为了确定这些元素的相对位置以便系统地进行研究,你设计了一些实验并得到了下列结果:
| 单质 | A | B | C | D | E | F | G | H | I | J |
| 熔点/℃ | -150 | 550 | 160 | 210 | -50 | 370 | 450 | 300 | 260 | 250 |
| 与水反应 | √ | √ | √ | √ | ||||||
| 与酸反应 | √ | √ | √ | √ | √ | √ | ||||
| 与氧气反应 | √ | √ | √ | √ | √ | √ | √ | √ | ||
| 不发生化学反应 | √ | √ | ||||||||
| 对于A元素 的原子质量 | 1.0 | 8.0 | 15.6 | 17.1 | 23.8 | 31.8 | 20.0 | 29.6 | 3.9 | 18.0 |
按照元素性质的周期性递变规律,试确定以上十种元素的相对位置,并填入下表:
| A | ||||||||||
| B | ||||||||||
| H | ||||||||||
参考答案
第一章 原子结构与性质
第一节 原子结构
【课内巩固】第一课时(原子的诞生,能层与能级,)
三、选择题
1 BC 2 D 3 D 4 C
四、填空题
5 越低 增高 6 2n2 7 3S 、3P 、3d
【课外提升】
一、选择题
1解析:当n为最外层时,最多为8个电子,由题意可知,第(n-1)层电子也为8个,而(n-1)为次外层,则n为M层;当n为次外层,其电子数比(n-1)层多10个,则证明n层最多容纳18个电子,也应为M层。答案:C 2 B
二填空题
3 ①原子中存在原子核,它占原子中极小的体积
②原子核带正电,且电荷数远远大于α粒子
③金的原子核质量远远大于α粒子
4交错
【高考链接】
一、往年高考
B
二、高考模拟题
解析:(1)略 (2)N2+3H2=2NH3 ,氮的氧化物
(3)NH4+ + H2O = NH3.H2O + H+
NH4HCO3 + 2NaOH = Na2CO3 + NH3 + 2H2O
【课内巩固】第二课时(构造原理,能量最低原理、基态与激发态、光谱)
一、选择题
1 C 2 D 3 C 4 D
二、填空题
5 基态 6吸收光谱或发射光谱 7略
【课外提升】
一、选择题
1 B 2 B
二填空题
3 解:
| 原子序数 | 电子排布式 | 价层电子排布 | 周期 | 族 |
| 1s22s22p63s23p63d104s24p64d105s25p1 | 5s25p1 | 5 | ⅢA | |
| 10 | 2s22p6 | 2 | 0 | |
| 24 | 1s22s22p63s23p63d54s1 | 4 | ⅥB | |
| 80 | 1s22s22p63s23p63d104s24p64d104f145s25p65d106s2 | 4f145d106s2 |
4 1s![]() 2s
2s![]() 2p
2p![]() 3s
3s![]() 3p
3p![]()
【高考链接】
一、往年高考
A.
二、高考模拟题
答:(1)因为1摩尔x同酸反应置换出1克的氢气,即0.5摩尔氢气,故x常见的氧化数为+1价,又因为氩是18号元素,因之x+离子是18个电子,所以x为19号元素K,y为31号元素Ga, z为35号元素Br。
(2)K原子电子排布式为:1s22s22p63s23p64s1
Ga3+的电子排布式为:1s22s22p63s23p63d10
Br-离子的电子排布式为:1s22s22p63s23p63d104s24p6
【课内巩固】第三课时(电子云与原子轨道)
一、选择题
1 B 2 C 3 本题从不同角度考查对电子云的理解程度: (1)核外电子的运动规律可用电子云来描述, 小黑点的疏密程度与电子出现机会多少相对应而不是电子数的多少。(2)电子云是一种形象的描述形式,并非真有带负电的云雾包围着原子核,因此不可能用高速照相机拍摄下来。答案:C 4 C
二、填空题
5 略 6 球 纺锤 Px、Py和Pz 7 洪特规则
【课外提升】
一、选择题
1 B 2 D
二填空题
3 略 4 (1)氧 磷 氯 2)H3PO4 HClO4 26、(1)x+n x-m (2)x+m x-n
【高考链接】
一、往年高考
|
(4)Be(OH)2+2NaOH → Na2BeO2+2H2O Li
二、高考模拟题
解析:本题是以化学知识为载体,综合了阅读能力、自学能力,以及相关学科——物理、生物、历史等的知识,综合考查了学生的科学素养,为今后的教学及学习提供了一定的参考价值。
答案:(1)二,ⅣA,8,4; (2) 8996~8595;
(3) B; (4)空气柱;
(5)![]() =4×20=80cm,f=
=4×20=80cm,f=![]() =
=![]() =415(Hz)。
=415(Hz)。
第二节 原子结构与元素性质
【课内巩固】第一课时(原子结构与元素周期表)
一、选择题
1 D 2 B 3 D 4 C
二、填空题
5 1)ns IA IIA 2)np IIIA-VIIA以及 0 3)(n-1)d IIIB-VIIB以及VIII
4)ns IB-IIB 5)镧系和锕系
6 答 : (1)Ba> Sr 同族元素Ba比Sr多一电子层。
(2)Ca>Sc 同周期元素,Sc核电荷多
7 Fr F 5 Tc
【课外提升】
一、选择题
1C 2分析:本题给出周期表中的部分元素的位置关系,根据该特点D、B、E不能是IA, IIA和IIIA族元素,且分别位于二、三、四周期; 根据相邻元素原子序数的关系,可知原子序数分别为A: Z-1, C:Z+1, D: Z-8, E: Z+8或Z+18, 因此五种元素的核电荷数之和可能为5Z或5Z+10 答案:A、C
二填空题
3 (A)H He C N O F Na Mg S Cl 7
(B)共价 H+ SO42-
(C)静电作用 离子
(D)离子 共价 火碱 烧碱 苛性钠
(E)H2 N2 O2 F2 Cl2 共价
(F)6号元素-氟(F)
(G)碱 酸
(H)离子 纯碱 正盐
(I)2 H2S、HCl HF H2O NH3 CH4
(J)MgO H2O
(K)2号元素-He
(L)(7)>(3)>(9),即NaOH>H2CO3>H2SO4
4 (1)七,ⅣA,金属; (2)XO2、X(OH)4,碱性; (3)XCl2,XCl4
【高考链接】
一、往年高考
(A)⑴ 右表中
⑵ IVA
⑶ ① 右表中
② 氯
H2S + Cl2→2HCl + S↓
 (B)
(B)
⑴ b
⑵ H
⑶ ① 右表中
② 镁
b、c
二、高考模拟题
分析:解答本题关键;①掌握1~20号元素的名称及符号;②掌握元素周期表的结构;③能根据元素周期表中元素性质递变规律进行分析判断。
答案:(1) N;Si;S;Ca;
(2) K;F;Ar
(3) HClO4;KOH;Al(OH)3;
3HClO4+Al(OH)3=Al(ClO4)3+3H2O
HClO4+KOH=KClO4+H2O
KOH+Al(OH)3=KAlO2+2H2O
(4) K; F
(5) ③Na; 可用它们跟水反应的实验证明: 钠跟水剧烈反应,放出氢气,并生成强碱;Mg跟沸 水才反应,放出氢气,并生成中强碱Mg(OH)2;Cl2;可用氯气通入溴化钠溶液的实验证明: 溶液呈棕红色,发生的反应为Cl2+2NaBr=2NaCl+Br2
【课内巩固】第二课时(元素周期律:原子半径,电离能,电负性)
一、选择题
1 D 2 C 3AD 4 C
二、填空题
5 电子的能层数 核电核数 6 减小 7 C
【课外提升】
一、选择题
1 B 2 C
二填空题
3解:F、S、As、Zn、Ca
1) 同周期中, 从左——向右, 分两个方面看:
① Z — 增大,对电子吸引力增大, r — 减小,
② Z — 增大,电子增加,之间排斥力增大,r —
增大。
这是一对矛盾, 以哪方面为主? 以 ①为主。
2)
同族中半径变化, 自上而下:
① Z — 增大,对电子吸引力增大, r — 减小,
② e — 增多,电子层增加, r — 增大。
这是一对矛盾, 以哪方面为主? 以 ②为主
4硼: 电子结构为: [He]![]() , 失去
, 失去
![]() 的一个电子, 达到
的一个电子, 达到 ![]() 全充满的稳定结构, 所以, I1 比较小.
全充满的稳定结构, 所以, I1 比较小.
N 氮:电子结构为: [He]![]() ,
, ![]() 为半充满结构, 比较稳定, 不易失去其上的电子, I1
突然增大.
为半充满结构, 比较稳定, 不易失去其上的电子, I1
突然增大.
O 氧:电子结构为: [He]![]() , 失去
, 失去![]() 的一个电子, 即可达到
的一个电子, 即可达到![]() 半充满稳定结构, 所以 I1 有所降低.(反而小于氮的第一电离能)
半充满稳定结构, 所以 I1 有所降低.(反而小于氮的第一电离能)
【高考链接】
一、往年高考
(1)①④
(2)①Li原子失去一个电子后,Li+已形成稳定结构,此时再失去一个电子很困难
②a Na2O和Na2O2 ③IIIA或第三主族 ④m
二、高考模拟题
答案:
| A | ||||||||||
| I | B | |||||||||
| C | D | J | G | E | ||||||
| H | F | |||||||||
 族 元
族 元