第13课时 电离平衡(1)
知识点 后 记:
(1)电解质与非电解质定义与实例。
(2)强电解质和弱电解质概念。从分类标准角度电解质和非电解质、强电解质和弱电
解质跟共价化合物、离子化合物等不同分类之间的关系。
(3)电离平衡等含义。
作业
1.下列各组物质全部是弱电解质的是( )。
(A)H2O、NH3·H2O、H3PO4、HF (B)Cu(OH)2、CH3COOH、C2H5OH、CH3COONa
(C)H2SO3、Ba(OH)2、BaSO4 (D)H2SiO3、H2S、CO2
2.下列物质的水溶液中,除水分子外,不存在其它分子的是( )。
(A)NaF (B)NaHS (C)HNO3 (D)HClO
3.医院里用HgCl2的稀溶液作手术刀的消毒剂,HgCl2熔融时不导电,熔点低。
关于HgCl2的描述合理的是( )。
(A)是难溶的共价化合物 (B)是离子化合物
(C)是一种强电解质 (D)是一种弱电解质
4.下列物质中,导电性能最差的是( )
(A)熔融氢氧化钠 (B)石墨棒 (C)盐酸溶液 (D)固体氯化钠
5.下列物质容易导电的是( )。
(A)熔融的氯化钠 (B)硝酸钾溶液 (C)硫酸铜晶体 (D)无水乙醇
6.将0.1 mol·L-1的CH3COOH溶液稀释10倍,下列微粒浓度减小得最多的是( )。
(A)CH3COO- (B)OH- (C)H+ (D)CH3COOH
7.浓度与体积都相同的盐酸和醋酸,在相同条件下分别与足量的碳酸钙固体(颗粒
大小均相同)反应,下列说法中正确的是( )。
(A)盐酸的反应速率大于醋酸的反应速率(B)盐酸的反应速率等于醋酸的反应速率
(C)盐酸产生的二氧化碳气体比醋酸更多(D)盐酸与醋酸产生的二氧化碳气体一样多
8.关于强电解质和弱电解质的区别,正确的叙述是( )。
(A)强电解质溶液的导电性强于弱电解质溶液的导电性
(B)强电解质在溶液中的电离度大于弱电解质在溶液中的电离度
(C)强电解质在任何浓度的溶液中都100%以离子的形态存在,而弱电解质则大多数
以分子的形态存在于溶液中
(D)在一般的浓度下,强电解质的一级电离是不可逆的,而弱电解质的电离是可逆的
9.试用简单的实验证明,在醋酸溶液中存在着:CH3COOH![]() H++CH3COO-的电离
H++CH3COO-的电离
平衡。要求从促进和抑制CH3COOH电离两个方面写出简要操作、现象及实验所能说
明的问题或结论。
第14课时 电离平衡(2)
知识点
(1)理解强、弱电解质分类跟电离平衡的本质联系。
(2)外界条件对电离平衡的影响
(3) 有关电离平衡计算
作业
1、下列物质的溶液中,存在电离平衡的是( )
A.Ca(OH)2 B. CH3COOH C. BaSO4 D CH3COONa
2、与50 mL 0.5 mol·L-1 (NH4)2SO4溶液中,[NH4+]浓度相同的溶液是( )。
(A)100 mL 1 mol·L-1的氨水 (B)200 mL 0.5 mol·L-1的NH4 Cl溶液
(C)50 mL 0.5 mol·L-1 的CH3 COONH4 溶液(D)200 mL 1 mol·L-1的NH4 NO3 溶液
3.有两种一元弱酸的钠盐溶液,其物质的量浓度相等。现向这两种盐的溶液中分别通
入适量的CO2,发生的反应如下:NaR + CO2 + H2O = HR+NaHCO3
2NaX + CO2 + H2O = 2HX+Na2CO3比较HR和HX酸性的强弱,正确的是( )。
(A)HR较弱 (B)HX较弱 (C)两者相差不大 (D)无法比较
4. 20℃时,1LH2S的饱和溶液,浓度约为0.1mol/L,其电离方程式为:
第一步:H2S ![]() H+ +
HS-
第二步:HS-
H+ +
HS-
第二步:HS-
![]() S2-+H+
S2-+H+
若要使该溶液的pH增大的同时c(S2-)减小,可采用的措施是( )。
(A)加入适量氢氧化钠固体 (B)加入适量水
(C)通入适量二氧化硫 (D)加入适量硫酸铜固体
5.把0.05mol NaOH固体分别加入到下列100ml液体中,溶液的导电性基本不变。
该液体是( )
A.自来水 B 0.5mol/L 盐酸 C、0.5 mol/L醋酸 D、0.5 mol/L氨水
6.用蒸馏水逐渐稀释0.1 mol/L氨水,若维持温度不变则在稀释过程中逐渐增大的是( )
A、NH 4+的物质的量浓度 B、 NH3·H2O的物质的量浓度
C. OH- 的物质的量浓度 D、NH 4+ 和OH-的物质的量
7.某二元酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A ![]() H++HA-
HA-
H++HA-
HA- ![]() H+ + A2- 设有下列四种溶液:
H+ + A2- 设有下列四种溶液:
(A)0.01mol/L的H2A溶液
(B)0.01mol/L的NaHA溶液
(C)0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合溶液
(D)0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合溶液
据此,填写下列空白(填代号):
(1)c(H+)最大的是_________,最小的是_________。
(2)c(H2A)最大的是_______,最小的是_________。
(3)c(A2-)最大的是_______,最小的是_________。
第15课时 水的电离和溶液的pH(1)
知识点
(1)理解水的电离、水的电离平衡和水的离子积。
(2)使学生了解溶液的酸碱性和pH的关系。
作业
1.室温下,在pH=12的某溶液中,由水电离出来的c(OH-)为( )。
(A)1.0×10-7 mol·L-1 (B)1.0×10-6 mol·L-1
(C)1.0×10-2 mol·L-1 (D)1.0×10-12 mol·L-1
2.25℃时,某溶液中由水电离出的c(H+)=1×10-12 mol·L-1,则该溶液的pH可能是( )。
(A)12 (B)7 (C)6 (D)2
3.纯水在25℃和80℃时的氢离子浓度,前者和后者的关系是( )。
(A)前者大 (B)相等 (C)前者小 (D)不能肯定
4.某温度下,重水(D2O)的离子积常数为1.6×10-15 若用定义pH一样来规定
pD=-lg[D+ ],则在该温度下,下列叙述正确的是( )。
(A)纯净的重水中,pD=7
(B)1 L溶解有0.01 mol DC1的重水溶液,其pD=2
(C)1 L溶解有0.01 mol NaOD的重水溶液,其pD=12
(D)纯净的重水中, [D+ ][OD- ]>1.0×10-1 4
5.给蒸馏水中滴入少量盐酸后,下列说法中错误的是( )。
(A)[H+ ][OH- ]乘积不变 (B)pH增大了
(C)[OH- ]降低了 (D)水电离出的[H+ ]增加了
6.常温下,下列溶液中酸性可能最弱的是( )。
(A)pH=4 (B)[H+ ]=1×10-3 mol·L-1
(C)[OH- ]=1×10-11 mol·L-1 (D)[H+ ] ·[OH- ]= 1×10-14
7.某酸溶液的pH=3,则该酸溶液的物质的量浓度为( )。
(A)一定大于0.001 mol·L-1 (B)一定等于0.001 mol·L-1
(C)一定小于0.001 mol·L-1 (D)以上说法均欠妥
8.在100℃时,Kw = 1.0×10-12,若在100℃时某溶液中的c(H+)= 1.0×10-2 mol·L-1,
则该溶液( )
A.呈中性 B、呈碱性 C、呈酸性 D、c(OH-)/c(H+)=100
9.今有a·盐酸 b·硫酸 c·醋酸三种酸:
(1)在同体积,同pH的三种酸中,分别加入足量的碳酸钠粉末, 在相同条件下产
生CO2的体积由大到小的顺序是_________________。
(2)在同体积、同浓度的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生
CO2的体积由大到小的顺序是_________________。
第16课时 水的电离和溶液的pH(2)
知识点
(1)理解溶液的pH。
(2)有关pH的简单计算。
(3)了解溶液pH的简单测定方法。
作业
1.将pH为5的硫酸溶液稀释500倍,稀释后溶液中c(SO![]() )和c(H+)之比约为( )。
)和c(H+)之比约为( )。
(A)1:1 (B)1:2 (C)1:10 (D)10:1
2.向VmLBaCl2溶液中加入一定体积的0.05mol/L硫酸溶液,两者恰好完全反应,且
反应后溶液的pH为3.0。则原BaCl2溶液的物质的量浓度为( )。
(A)5.05×10-4 mol·L-1 (B)5.05×10-3 mol·L-1
(C)1.01×10-4 mol·L-1 (D)1.01×10-3 mol·L-1
3.下列叙述中正确的是( )。
(A)使甲基橙试液变黄色的溶液一定是碱性溶液
(B)使酚酞试液变红色的溶液一定是碱性溶液
(C)使甲基橙试液变红色的溶液一定是酸性溶液
(D)使紫色石蕊试液不变色的溶液一定是中性溶液
4.下列试纸使用时, 不宜先用水润湿的是( )。
(A)pH试纸 (B)红色石蕊试纸 (C)淀粉碘化钾试纸 (D)蓝色石蕊试纸
5.将质量百分比浓度为a%、物质的量浓度为c1 mol·L-1的稀硫酸蒸发掉一定量的水,
使之质量百分比浓度为2a%,物质的量浓度为c2 mol·L-1,则c1和c2的关系是( )。
(A)c2 =2 c1 (B)c2 >2 c1 (C) c2 <2 c1 (D)c1 = 2c2
6.从植物花中提取一种有机物,可用简化式HIn表示,在水溶液中因存在下列电离平
衡,故可作酸碱指示剂:HIn(溶液红色) ![]() H+(溶液)+In-(溶液黄色) 。在该水溶液
H+(溶液)+In-(溶液黄色) 。在该水溶液
中加入下列物质,能使指示剂显黄色的是( )。
(A)盐酸 (B)碳酸钠溶液 (C)硫酸氢钠溶液 (D)过氧化钠
7. 在25℃时,有pH为a的盐酸和pH为b的NaOH溶液,取VaL该盐酸,同该
NaOH溶液中和,需Vb L NaOH溶液,填空:
(1)若a+b=14,则Va:Vb=____________(填数字)。
(2)若a+b=13,则Va:Vb=____________(填数字)。
(3)若a+b>14,则Va:Vb=_____________(填表达式),且Va_________ Vb
(填:>、<、=)(题中a≤6、b≥8)。
8.250 mL pH=12的某一元强碱(MOH)溶液与250 mL 0.025 mol·L-1 的硫酸溶液相混合,
假设混合后液体体积为500 mL。试求:
(1)混合液的pH;
(2)若原250 mL一元强碱中含溶质0.1 g, 则M的相对原子质量为多少?
第17课时 盐类的水解(1)
知识点
(1)盐组成规律、盐的分类。
(2)盐溶液酸碱性测试。
(3)水解原理、盐类水解对溶液酸碱性的影响、强酸弱碱盐、强碱弱酸盐的水解反应分析。
作业
1.在水中加入下列物质,可使水的电离平衡向电离方向移动的是( )
(A)硫酸 (B)氢氧化钾 (C)氯化铁 (D)硝酸钡
2. 下列离子中,在溶液中不发生水解的是( )
A.Cu2+ B.I- C.SO32- D.F-
3.四种等浓度的溶液①HCl,②FeCl3,③KOH,④Na2CO3其 pH值的大小关系正确的是( )
(A)①>②>③>④ (B) ④>③>②>①
(C)③>④>②>① (D) ①>②>④>③
4.在一定浓度的FeCl3溶液中,存在如下水解平衡:
Fe3+ + 3H2O![]() Fe(OH)3+3H+ 加水稀释过程中,下列哪个变化的说法正确( )。
Fe(OH)3+3H+ 加水稀释过程中,下列哪个变化的说法正确( )。
(A)水解平衡向正反应方向移动 (B)水解平衡向逆反应方向移动
(C)溶液中H+离子浓度增大 (D)Fe3+ 的水解程度增大
5.常温下,将0.1mol的下列物质置于0.5L水中,充分搅拌后,溶液中阴离子数目
从大到小的排列顺序正确的是( )。
①Na2O2 ②Ba3(PO4)2 ③Na2S ④NaAlO2 ⑤AlCl3
(A)⑤①③④② (B)⑤②①③④ (C)⑤①④③② (D)②⑤①③④
6. 物质的量浓度相同的NaX、NaY、NaZ的溶液,其pH值依次为8、9、10则HX、
HY、HZ的酸性由强到弱的顺序是( )
(A) HX>HZ>HY (B) HZ>HY>HX (C) HX>HY>HZ (D) HY>HZ>HX
7.(1)碳酸钾的水溶液蒸干得到的固体物质是________,原因是___________________。
(2)KAl(SO4)2溶液蒸干得到的固体物质是________,原因是__________________。
(3)碳酸氢钡溶液蒸干得到的固体物质是________,原因是___________________。
(4)亚硫酸钠溶液蒸干得到的固体物质是________,原因是___________________。
(5)氯化铝溶液蒸干得到的固体物质是________,原因是_____________________。
(6)盐酸和硫酸浓度各为1 mol·L-1的10mL混合酸,加热浓缩至1mL,最后的溶液的浓度为_______,
原因是______________________。
8.有体积相同的碳酸钾和碳酸铵溶液,物质的量浓度分别为c1和c2,现测得两种溶
液所含的CO32-的数目相等,则c1______c2(填>、<、=)。
第18课时 盐类的水解(2)
知识点
(1)弱酸弱碱盐水解规律。
(2)温度等外界条件对盐类水解反应的影响、水解平衡移动的分析。
(2)水解原理的应用。
作业
1.下列各反应中属于水解反应的是( )
A.HCO3- + H2O![]() H3O+ + CO32- B. HCO3- + H2O
H3O+ + CO32- B. HCO3- + H2O![]() H2CO3
+OH-
H2CO3
+OH-
C. HCO3- +
OH-![]() H2O + CO32- D.
H2PO4- + H2O
H2O + CO32- D.
H2PO4- + H2O ![]() H3O+
+ HPO42-
H3O+
+ HPO42-
2.下列物质在常温下发生水解反应时,对应的离子反应方程式正确的是( )
A.Na2CO3: H2O + CO32-![]() H2CO3
+2OH-
H2CO3
+2OH-
B. NH4Cl: NH4+
+ H2O![]() H+ + NH3·H2O
H+ + NH3·H2O
C. CuSO4: Cu2+ + H2O![]() 2H+ + Cu(OH)2↓
2H+ + Cu(OH)2↓
D.NaF: F- + H2O![]() HF + OH-
HF + OH-
3.在Na2HPO4溶液中,存在着下列平衡:
HPO![]()
![]() H+ + PO
H+ + PO![]() HPO
HPO![]() +H2O
+H2O ![]() H2PO
H2PO![]() +OH- 已知该溶液呈
+OH- 已知该溶液呈
碱性。欲使溶液中的HPO![]() 、H+、PO
、H+、PO![]() 浓度都减小,可采取的方法是( )。
浓度都减小,可采取的方法是( )。
(A)加石灰水 (B)加盐酸 (C)加烧碱 (D)用水稀释
4.常温下,将0.1mol的下列物质置于0.5L水中,充分搅拌后,溶液中阴离子数目从
大到小的排列顺序正确的是( )。
①Na2O2 ②Ba3(PO4)2 ③Na2S ④NaAlO2 ⑤AlCl3
(A)⑤①③④② (B)⑤②①③④
(C)⑤①④③② (D)②⑤①③④
5.25℃时,浓度为1mol·L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,
若测得其中c(NH4+)为分别为a、b、c (单位为mol·L-1),则下列判断正确的是( )。
(A)a=b=c (B)c>a>b (C)b>a>c (D)a>c>b
6.写出下列物质在常温下发生水解反应的离子反应方程式,并指出水溶液的酸碱性:
(1) 醋酸钠:_______________________________________
(2) 硝酸铵:________________________________________
(3) 碳酸钠:_________________________________________
(4) 醋酸铵:_________________________________________
(5) 硫酸铵:_________________________________________
(6) 氟化铵:__________________________________________
第19课时 盐类的水解(3)
知识点
水解原理的应用。
作业
1.在NH4Cl溶液中各离子的物质的量浓度由大到小的关系正确的是( )
(A).[Cl-]>[NH4+]>[H+]>[OH-] (B) . [NH4+]>[Cl-]>[OH-]>[H+]
(C).[NH4+]>[Cl-]>[OH-]>[H+] (D). [Cl-]>[NH4+]>[OH-]>[H+]
2.0.100mol«L-1的Na2S的溶液中,下列关系不正确的是( )。
(A)[H2S]+[HS-]+[S2-]=0.1 (B)[Na+]+[H+]=2[S2-]+[HS-]+[OH-]
(C)[OH-]=[H+]+[HS-]+2[H2S] (D)[Na+]+[H+]=[S2-]+[HS-]+[OH-]
3.常温下pH=3的二元弱酸H2R溶液与VLpH=11的NaOH溶液混合后,混合液pH=7。
下列判断正确的是( )。
(A)溶液总体积为2VL (B)溶液中[R2-]>[Na+]>[H+]=[OH-]
(C)溶液中[R2-]>[OH-] =[Na+]+H+] (D)溶液中2[R2-]+[HR-]=[Na+]
4.室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸,直至盐酸过量。请分析
上述实验过程中①所发生的反应②溶液的成分③溶液的pH值变化,并回答下列问题:
(1)该反应的离子方程式为______________________________________________。
(2)在实验过程中水的电离度的变化趋势是先_______后_______(选填“大”、“小”、“不变”)。
5.将0.02mol·L-1的HCN溶液与0.02 mol·L-1NaCN溶液等体积混合,已知该混合溶液
中[Na+]>[CN-],用“>、<、=”符号填空。
①溶液中[OH-]___________[H+];
②溶液中[HCN]___________[CN-];
③溶液中[HCN]+[CN-]_________0.02 mol·L-1。
6.①向明矾溶液中逐滴滴入氢氧化钡溶液至硫酸根离子刚好沉淀完全时,溶液的
pH_____7(填>、<、=),离子反应总方程式为______________________________;
②向明矾溶液中逐滴加氢氧化钡至铝离子刚好沉淀完全时,溶液的pH_____7
(填>、<、=),离子反应总方程式为______________________________________。
7.某厂得知市场紧缺无水氯化镁,而工厂仓库内存在大量的氧化镁、氯化铵、二氧化
锰、盐酸和炭。于是技术科设计了两种制造工艺进行试产后,投入生产,使工厂扭亏
为盈。试问:技术产设计的两种制造工艺是(有反应方程式表明工艺流程)。
第一种:__________________________________________________________。
第二种:__________________________________________________________。
评估此两种工艺的经济效益____________________________________。
第20课时 酸碱中和滴定(1)
知识点
(1)掌握酸碱中和滴定概念。
(2)理解酸碱中和反应的实质。
(3)熟记酸碱中和滴定实验用到主要仪器名称、仪器的用途。
(4)掌握中和滴定实验计算的步骤和方法。
作业
1.有一支50mL酸式滴定管,其中盛有溶液,液面恰好在10.0mL刻度处。把滴
定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积( )。
(A)大于40.0mL (B)为40.0mL (C)小于40.0mL (D)为10.0mL
2.准确量取25.00mL高锰酸钾溶液,可选用的仪器是( )。
(A)50mL 量筒 (B)10mL量筒
(C)50mL 酸式滴定管 (D)50mL碱式滴定管
3.已知常温、常压下,饱和CO2的水溶液的pH=3.9,则可推断用标准盐酸溶液滴
定碳酸氢钠水溶液时,适宜选用的指示剂及滴定终点时颜色变化的情况是( )。
(A)石蕊,由蓝变红 (B)甲基橙,由橙变黄
(C)酚酞,红色褪去 (D)甲基橙,由黄变橙
4.进行中和滴定时,事先不应该用所盛溶液润洗的仪器是( )。
(A)酸式滴定管 (B)碱式滴定管 (C)锥形瓶 (D)量筒
5.在25℃时向VmLpH= a的盐酸中,滴加pH=b的NaOH溶液10VmL时,所得
的混合溶液中c(Cl-)=c(Na+),则此时a+b为( )。
(A)13 (B)14 (C)15 (D)10
6.实验室中有0.1mol/L的H3PO4溶液,有未知浓度的Ba(OH)2溶液和常用的仪器。
(1)若采用中和滴定的方法来测定氢氧化钡溶液的物质的量浓度,
通常用到铁架台外,还有_______________。
(2)若实验室没有指示剂,你认为能否测定出氢氧化钡物质的量浓度。
(3)若测定出氢氧化钡溶液浓度为0.1 mol·L-1,取该溶液30mL,向其中慢慢滴
入0.1 mol·L-1磷酸溶液直到过量。在如图中,以沉淀的物质的量(10-3mol)为纵
 轴,加入磷酸溶液体积(mL)为横轴作图。
轴,加入磷酸溶液体积(mL)为横轴作图。
7.滴定度是指每毫升标准溶液相当于被测定物质的克数,通常用T(M1/M2)表示。如T(H2SO4/NaOH)=0.040g· mL-1,表示每毫升标准硫酸溶液恰好中和0.040gNaOH。
(1)若要使某标准盐酸对氧化钙的滴定度为T(HCl/CaO)=0.0056g· mL-1,则该盐酸物质的量浓度是多少?
(2)上述盐酸对氢氧化钠的滴定度是多少?
第21课时 酸碱中和滴定(2)
知识点
(1)熟练中和滴定实验有关仪器(锥形瓶、移液管和滴定管等)的基本操作规范。
(2)理解中和滴定实验中指示剂选择、使用。
(3)理解中和滴定实验过程要记录的实验数据。
作业
1.给滴定管中注入标准溶液的方法,正确的是( )。
(A)借助于玻璃棒 (B)借助于漏斗 (C)借助于胶头滴管 (D)直接注入
2.某同学在实验报告中有以下的实验数据:①用托盘天平称取11.7g食盐,②用量
筒量取5.26 mL盐酸,③用广泛pH试纸测得溶液的pH是3.5,④用标准NaOH溶
液滴定未知浓度的盐酸,用去23.10 mL NaOH溶液。其中数据合理的是( )。
(A)①②③ (B)①③④ (C)①②③④ (D)①④
3.用已知浓度的强酸滴定未知浓度的强碱溶液时,会导致待测碱液浓度结果偏低的
操作是( )。
(A)锥形瓶用蒸馏水洗净后装待测液 (B)滴定管用蒸馏水洗净后注入标准液
(C)滴定前仰视读数, 滴定后俯视读数 (D)配制碱液时, 称量后固体吸湿
4.20 mL 0.1 mol·L-1HxROn 溶液和16 mL 0.25 mol·L-1的Z(OH)y溶液完全中和,则
x : y的值为(设该酸为x元酸, 该碱为y元碱)( )。
(A)2:1 (B)1:2 (C)5:4 (D)4:5
5.向10 mL pH=2的某酸溶液中加入10mL pH=12的NaOH溶液,充分反应后,滴入
石蕊试液,溶液显红色,则此酸一定是( )。
(A)一元强酸 (B)弱酸 (C)多元强酸 (D)任何强酸
6.用0.01 mol·L-1H2SO4滴定0.01 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定
时终点判断有误差:①多加了一滴H2SO4;②少加了一滴H2SO4(设一滴为0.05mL)。
则①和②中[H+]之比的值是( )。
(A)10 (B)50 (C)5×103 (D)104
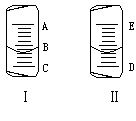 7.(1)如图(Ⅰ)表示10mL量简中液面的位置,A与B,
7.(1)如图(Ⅰ)表示10mL量简中液面的位置,A与B,
B与C刻度间相差1mL,如果刻度A为4,量简中液体的
体积是________mL。
(2)如图(Ⅱ)表示50mL滴定管中液面的位置,如果液
面处的读数是a,则滴定管中液体的体积(填代号)_________。
(A)是a mL (B)是(50-a)mL
(C)一定大于a mL (D)一定大于(50-a)mL
8.根据电离平衡移动的原理,设计两种实验方法,证明氨水是一种弱碱。除氨水外,
限从以下范围内选用试剂:蒸馏水、酚酞指示剂、石蕊指示剂、氯化铵晶体、消石灰、
浓盐酸、醋酸铵晶体。
第22--23课时 第三章单元检测题
(时量:90分钟 满分:100分)
一、选择题(每题有1—2个正确答案,每小题3分,共48分)
1.“垃圾是放错了位置的资源”,应该分类回收.生活中废弃的铁锅、铝制易拉罐、
铜导线等可以归为一类并加以回收,它们属于( )
A.氧化物 B.电解质 C.金属或合金 D.非电解质
2.日常生活中人们常喝纯净水,市场上出售的纯净水有一些是蒸馏水.对于这一类纯
净水的下列说法,正确的是( )
A.它能够导电 B.它含有人体所需的矿物质和多种微量元素
C.它的pH=0 D.它清洁、纯净,但长期饮用对健康无益
3.水的电离过程为![]() ,在不同温度下其离子积常数为
,在不同温度下其离子积常数为
![]() ,
,![]() .则下列叙述正确的是( )
.则下列叙述正确的是( )
A.![]() 随着温度的升高而降低 B.在35℃时,水中的
随着温度的升高而降低 B.在35℃时,水中的![]()
C.水的电离度α(25℃)较大 D.水的电离是吸热的
4.下列物质的水溶液能导电,但属于非电解质的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
5.取pH均等于2的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03g锌粉,
在相同条件下充分反应,有前叙述正确的是( )
A.醋酸与锌反应放出氢气多 B.盐酸和醋酸分别与锌反应放出氢气一样多
C.醋酸与锌反应速率大 D.盐酸和醋酸分别与锌反应的速率一样大
6.在含有酚酞的0.1mol/L氨水中加入少量的![]() 晶体,则溶液颜色( )
晶体,则溶液颜色( )
A.变蓝色 B.变深 C.变浅 D.不变
7.将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,溶液显酸性,则
溶液中有关微粒的浓度关系正确的是( )
A.![]()
B.![]()
C.![]()
D.![]()
8.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
9.在一支25mL的酸式滴定管中盛入0.1mol/LHCl溶液,其液面恰好在5mL的刻度处,
若把滴定管中的溶液全部放入烧杯中,然后以0.1mol/LNaOH溶液进行中和,则所需
NaOH溶液的体积( )
A.大于20mL B.小于20mL C.等于20mL D.等于5mL
10.某二元酸![]() 在水中发生电离:
在水中发生电离:![]() ,
,![]()
![]()
![]() .
.
下列叙述不正确的是( )
A.NaOH溶液中:![]()
B.![]() 溶液中:
溶液中:![]()
C.在NaHA溶液中:![]()
D.![]() 溶液中:
溶液中:![]()
11.在![]()
![]()
![]() 形成的平衡中,要使
形成的平衡中,要使![]() 的
的
电离程度及![]() 都增大,可采取的措施是(
)
都增大,可采取的措施是(
)
A.通入HC1 B.加少量NaOH固体 C.加水 D.升温
12.PH=3的醋酸用水稀释,体积为原体积的2倍后,这时溶液的pH接近( )
A.1.5 B.3.1 C.3.5 D.2.7
13.一定量的盐酸跟过量的铁粉反应时,为了减慢反应速率,且不影响生成氢气的总
量,可向盐酸中加入的适量物质是( )
A.NaOH固体 B.![]() 晶体 C.NaC1固体
D.
晶体 C.NaC1固体
D.![]()
14.把![]() 固体放入一定量的蒸馏水中,一定温度下达到平衡:
固体放入一定量的蒸馏水中,一定温度下达到平衡:
![]() (固)
(固)![]()
![]() .当向悬浊液中加入少量生石灰后,若温度
.当向悬浊液中加入少量生石灰后,若温度
保持不变,下列判断正确的是( )
A.溶液中![]() 数目减少
B.溶液中
数目减少
B.溶液中![]() 增大
增大
C.溶液pH值不变 D.溶液pH值增大
15.下列说法不正确的是( )
A.强电解质溶液不一定比弱电解质溶液的导电性强
B.强电解质的水溶液中不存在溶质分子
C.强电解质都是离子化合物,而弱电解质都是共价化合物
D.不同的弱电解质溶液只要物质的量浓度相同,电离程度也相同
16.分别在pH=1的酸和pH=14的NaOH溶液中加入足量的A1,放出![]() 的量前者多,
的量前者多,
其原因可能是( )
A.两溶液体积相同,酸是多元强酸
B.两溶液体积相同,酸是一种弱酸
C.酸溶液体积大于NaOH溶液体积
D.酸是强酸,浓度比NaOH溶液的大
二、填空题
17.(4分)相同物质的量浓度的下列物质的溶液①![]() ②
②![]() ③
③![]()
④![]() ,其pH值由大到小的顺序正确的是________________________.
,其pH值由大到小的顺序正确的是________________________.
18.(6分)![]() 在水中强烈水解,25℃时,2mol/L的
在水中强烈水解,25℃时,2mol/L的![]() 溶液中的水解度(已发
溶液中的水解度(已发
生水解的离子占总量的百分数)高达80%,而相同温度下0.008mol/L ![]() 在水中
在水中
的水解度仅为1.4%.![]() 水解性明显强于
水解性明显强于![]() 的可能的原因为:
的可能的原因为:
①________________________________________________;
②________________________________________________.
19.(4分)判断下列各组溶液等体积混合后混合液的pH
①![]() 和0.1mol/LKOH_________________________________;
和0.1mol/LKOH_________________________________;
②![]() 溶液和0.1mol/LNaOH溶液_________________________;
溶液和0.1mol/LNaOH溶液_________________________;
③0.1mol/L氨水和0.1mol/L盐酸__________________________________;
④pH=3的醋酸和pH=11NaOH溶液_______________________________.
20.(6分)![]() (氢叠氮酸)的钠盐
(氢叠氮酸)的钠盐![]() (叠氮酸钠)可用于汽车防撞气袋.撞车
(叠氮酸钠)可用于汽车防撞气袋.撞车
时约在10毫秒(1毫米=10-3秒)内引发下列反应:![]() .反应在
.反应在
约30毫秒内完成,袋内充满![]() 而胀大,阻止人体向前冲撞.已知
而胀大,阻止人体向前冲撞.已知![]() (氢叠氮酸)
(氢叠氮酸)
的酸性与醋酸相近,则可推知0.1mol/L的![]() 溶液中的
溶液中的![]() _______(填“大于”、
_______(填“大于”、
“小于”或“等于”)0.1mol/L;而![]() 溶液显________(填“酸”、“碱”或“中”).
溶液显________(填“酸”、“碱”或“中”).
21.(4分)某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合后,
pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的关系为V(碱)=_______酸).
22.(6分)有一学生在实验室测某溶液的pH,实验时,他先用蒸馏水润湿pH试纸,
然后用洁净干燥的玻璃棒蘸取试样进行检测.
(1)该学生的操作方法是否正确?_________________________________.
(2)如不正确请说明理由,同时分析是否一定会产生误差?___________.
(3)若用此法分别测定![]() 相等的盐酸和醋酸溶液的pH,结果会怎样?
相等的盐酸和醋酸溶液的pH,结果会怎样?
__________________________________________________________________.
23.(4分)![]() 与水的反应
与水的反应![]() 可看作是
可看作是![]() 与
与![]()
“互换成分”的水解反应:
![]()
据此推断:
(1)卤素互化物IBr与水反应的产物为_______________、______________.
(2)C1CN是一种暂时性毒剂,其水解的反应方程式为___________________.
24.(6分)已知0.1mol/L醋酸溶液的pH值约为3.向其中加放少量醋酸钠晶体,待
晶体溶解后发现溶液的pH值增大.对上述现象有两种不同的解释:甲同学认为醋酸
钠水解呈碱性,增大了![]() ,因此溶液的pH值增大;乙同学认为醋酸钠溶于水
,因此溶液的pH值增大;乙同学认为醋酸钠溶于水
电离出大量醋酸根离子,抑制了醋酸的电离,使![]() 减小,因此溶液的pH值增大.
减小,因此溶液的pH值增大.
(1) 为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L醋酸溶液中加入
少量下列物质___________________(填写编号),然后测定溶液的pH值.
A.固体![]() B.固体
B.固体![]() C.气体
C.气体![]() D.固体
D.固体![]()
(2) 若甲的解释正确,溶液的pH应__________(填“增大”、“减小”或“不变”);
若乙的解释正确,溶液的pH应______________(填“增大”、“减小”或“不变”).
(已知:25%时,0.1mol/L氨水的电离程度与0.1mol/L醋酸的电离程度基本相同.)
三、简答题
25.(6分)将一定体积的空气通入吸收剂,并测定其电导的变化,这种方法可以测定
空气中污染物的含量.如测定硫化氢,用硫酸铜溶液吸收,可测定很大浓度范围的硫
化氢,但电导变化不大;用溴水吸收,仅适用于低浓度范围,但有很高的灵敏度.现
要兼顾吸收容量和灵敏度,则测定空气中![]() 的含量,可选用
的含量,可选用![]() 溶液吸收剂,
溶液吸收剂,
试分析原因.
________________________________________________________________
________________________________________________________________.
26.实验室制备![]() 固体,可采用如下操作:
固体,可采用如下操作:
将A1溶于过量硫酸,将所得溶液蒸干灼烧,最后得到的固体产物主要为![]() .
.
但采用类似的方法制备![]() 固体,即将A1溶于过量盐酸,将所得溶液蒸干灼烧,最
固体,即将A1溶于过量盐酸,将所得溶液蒸干灼烧,最
后却未能得到![]() 固体.请解释原因并说明最终得到的固体物质主要是什么?
固体.请解释原因并说明最终得到的固体物质主要是什么?
_______________________________________________________________
_______________________________________________________________.