 高二化学第一学期期末考试试卷
高二化学第一学期期末考试试卷
(时间:90分钟 满分100分) 2006年1月
| 题号 | 一 | 二 | 三 | 四 | 五 | 总分 |
| 得分 |
相对原子质量:H—1 O—16 Fe—56 Mg—24 Al—27
一、选择题(每小题只有一个正确选项,将正确的选项填入下表中,共40分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
1、下列不含碳碳双键的物质是…………………………………………………………( )
(A)乙烯 (B)丁烯 (C)聚乙烯 (D)聚1,3--丁二烯
2、利用铝合金代替铝制钥匙是利用铝合金的…………………………………………( )
(A)熔点低 (B)不易锈蚀 (C)硬度大 (D)密度小
3、下列物质中,不能用单质直接化合而得到的是……………………………………( )
(A)FeCl3 (B)FeCl2 (C)FeS (D)Fe3O4
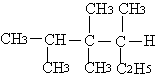 |
4、按系统命名法 的正确命名是…………………………( )
(A)3,3,4—三甲基—2—乙基戊烷 (B)3,4,4,5—四甲基己烷
(C)2,3,3—三甲基—2—乙基——戊烷 (D)2,3,3,4—四甲基己烷
5、下列叙述中错误的是…………………………………………………………………( )
(A)点燃甲烷不必象点燃氢气那样事先验纯;
(B)甲烷燃烧能放出大量的热,所以是一种很好的气体燃料;
(C)煤矿的矿井要注意通风和严禁烟火,以防爆炸事故的发生;
(D)如果隔绝空气,将甲烷加热到1000℃以上,能分解成炭黑和氢气。
6、制备干燥氨气所需的药品是…………………………………………………………( )
(A)NH4Cl溶液、NaOH溶液、碱石灰 (B)饱和氨水
(C)NaOH溶液、NH4Cl晶体、浓硫酸 (D)NH4Cl固体、碱石灰、消石灰
7、下列物质中既能发生取代反应,又能发生加成反应的是…………………………( )
(A)甲烷 (B)乙烯 (C)乙炔 (D)苯
8、天然气、液化石油气燃烧的化学方程式分别为:
![]() 、
、![]()
现有一套以液化石油气为燃料的灶具,改燃天然气,应采用的正确措施是………( )
(A)两种气体进入量都减少 (B)增大空气进入量或减少天然气进入量
(C)两种气体进入量都增大 (D)减少空气进入量或增大天然气进入量
9、把生铁炼成碳素钢的主要目的是………………………………………………… ( )
(A)除去杂质(脉石)
(B)除去全部C 、Si、S、P等杂质
(C)主要是加入合金元素,改善生铁的性能
(D)降低含碳量,除去S、P等有害杂质,调整合金元素含量。
10、常温下能用铁制容器盛放的是……………………………………………………( )
(A)浓盐酸 (B)浓硝酸 (C)稀盐酸 (D)稀硝酸
1![]() 1、在N2+3H2 2NH3的反应中,经过2s后,NH3的浓度增加了0.6mol·L-1, 此段时间内H2的平均反应速率是……………………………………………………( )
1、在N2+3H2 2NH3的反应中,经过2s后,NH3的浓度增加了0.6mol·L-1, 此段时间内H2的平均反应速率是……………………………………………………( )
(A)0.45 mol·(L·s)-1 (B)0.045 mol·(L·s)-1
(C)0.3 mol·(L·s)-1 (D)0.03 mol·(L·s)-1
12、关于实验室制备乙烯的下列说法正确的是………………………………………( )
(A)反应物是乙醇和过量的3 mol·L-1 H2SO4的混和液;
(B)温度计插入反应溶液液面下,以便控制温度在140℃;
(C)反应完毕,先灭火再从水中取出导管;
(D)反应容器(烧瓶)中应加入少量瓷片。
13、下列有关Fe(OH)3胶体的说法中不正确的是………………………………………( )
(A)Fe(OH)3胶体是带正电荷的
(B)Fe(OH)3胶体能产生丁达尔现象
(C)Fe(OH)3胶体微粒不停地作无规则运动
(D)Fe(OH)3胶体微粒在直流电场中向阴极移动
14、铁属于:⑴重金属;⑵轻金属;⑶常见金属;⑷稀有金属;⑸黑色金属;⑹有色金属……………………………………………………………………………………( )
(A)⑴⑵⑸ (B)⑵⑶⑸ (C)⑴⑶⑸ (D)⑴⑷⑹
15、镁粉在焰火、闪光灯、鞭炮的制造中是不可少的原料。工业上制造镁粉是将镁蒸汽在某气体中冷却制得,以下气体:①空气 ②CO2 ③Ar ④H2 ⑤N2可作为Mg的冷却气体的是………………………………………………………………………………( )
(A)③、④ (B)②、③ (C)③、⑤ (D)①、④
16、下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是( )
(A)2NO2![]() N2O4 (正反应为放热反应)
N2O4 (正反应为放热反应)
(B)3O2![]() 2O3 (正反应为吸热反应)
2O3 (正反应为吸热反应)
(C)H2
(g) + I2 (g)![]() 2HI (正反应为放热反应)
2HI (正反应为放热反应)
(D)NH4HCO3(s)
![]() NH3
+ H2O (g) + CO2
(正反应为吸热反应)
NH3
+ H2O (g) + CO2
(正反应为吸热反应)
17、下列反应中属于加成反应的是……………………………………………………( )
(A)丙烷和氯气反应 (B)丙烯和氧气反应
(C)乙烯和溴水反应 (D)由乙烯制聚乙烯
18、下列各组离子能在无色透明的酸性溶液中大量共存的是………………………( )
(A)NH4+、AlO2-、NO3-、Na+ (B)Fe3+、Cl-、K+、SO42-
(C)Al3+、SO42-、NH4+、NO3- (D)Fe2+、NO3-、K+、Cl-
19、用NA表示阿佛加德罗数,以下说法正确的是…………………………………( )
(A)1mol NH3 分子中,共用的电子数为3NA
(B)27g铝与足量的烧碱溶液反应时,生成NA个H2分子
(C)1.2g金属镁变成离子时,共失去的电子数为0.1NA
(D)1.8g纯水含有的原子总数为0.1NA 。
 20、下列图示表示往用硫酸酸化的硫酸铝溶液中滴加氢氧化钠溶液时生成沉淀M和所加入氢氧化钠溶液体积V的关系,其中正确的是……………………………… ( )
20、下列图示表示往用硫酸酸化的硫酸铝溶液中滴加氢氧化钠溶液时生成沉淀M和所加入氢氧化钠溶液体积V的关系,其中正确的是……………………………… ( )
(A) (B) (C) (D)
二、填空题(40分)
21、氮族元素位于元素周期表的_____族,包括_______________________(填元素符号),其中非金属性最强的是_____;随着核电荷数的递增,氮族元素的原子半径逐渐________,得电子能力逐渐________,其气态氢化物的稳定性逐渐________。
22、配平下列反应方程式并标出电子转移的方向和数目:
_____FeO+_____HNO3 → _____Fe(NO3)3+____NO↑+____H2O
反应中______元素被氧化,当产生2.24 L(标准状况)NO气体时,转移电子______________个。
23、以下有五种有机物
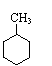

![]()

① ② ③ ④ ⑤
这些物质中______是苯的同系物,_________是苯发生取代反应后的生成物,________是苯的同系物发生加成反应后的生成物。(用上述有机物序号填空)。
24、化学反应3A+B ![]() 2C达到化学平衡后,根据以下条件各选择正确的选项填空(填序号):
2C达到化学平衡后,根据以下条件各选择正确的选项填空(填序号):
(1)降低温度时,C的量增加,此反应_____________
(A)正反应是放热反应 (B)正反应是吸热反应
(C)正反应速率加快 (D)化学平衡不移动
(2)如果A、B、C都是气体,达到平衡时增大压强,那么____________
(A)平衡不移动 (B)C的浓度会增大
(C)平衡向逆反应方向移动 (D)逆反应速率减慢
25、2005年11月13日,中国石油吉林石化公司双苯厂发生爆炸事故,造成松花江硝基苯严重污染,硝基苯有毒,与皮肤接触或吸入它的蒸汽都能引起中毒。
写出苯与混酸(浓硫酸与浓硝酸)反应生成硝基苯的化学方程式:
_________________________________________________________________
在苯的硝化反应中,加热的方法是______,其优点是____________,浓硫酸在反应中的作用是________________,温度计的水银球应插在_________,温度不宜过高的原因是______________________________________。
26、镁铝合金溶于过量盐酸中,所得溶液中的阳离子为___________;加入过量氢氧化钠溶液后,溶液中减少的离子有____________;增加的离子有__________;再加入过量盐酸后,减少的离子有____________,增加的离子有___________。
27、雷鸣电闪是日常生活中常见的自然现象,地球上每年平均发生315160次闪电。
|
![]() ① N2 + O2
2NO
① N2 + O2
2NO
② __________________________________________________;
③ __________________________________________________;
④ __________________________________________________。
(2)由此说明闪电对人类生活有何益处?_____________________________________________________________。
三、实验题(14分)
28、有一无色混合气体,可能由CO2、HCl、NH3、O2、NO2、NO中的几种组成,经以下实验:
(1)混合气体通过浓硫酸时,气体体积明显减少,
(2)再通过碱石灰,气体体积又明显减少,
(3)剩余气体与空气接触时,立即变成红棕色。
则原混合气体中,一定有___________________,一定没有_____________。

29、右图是实验室制取溴苯的装置图:
(1)写出实验室制取溴苯的化学方程式:
_________________________________________________。
(2)双球吸收管中四氯化碳的作用是___________,
小试管中可见到____________现象,写出有关的化学方程式__________________。
(3)反应完毕后,将具支试管中的液体倒入盛有氢氧化钠溶液的烧杯里,可以观察到烧杯底部有_____________________的液体,这是_______________物质。
四、计算题(6分)
30、已知某种赤铁矿1克溶于足量盐酸中,过滤后所得的滤液中加入足量的NaOH溶液,产生1.177克红褐色沉淀。求:
(1)赤铁矿中氧化铁的质量分数。
(2)若用此赤铁矿50吨能炼得含杂质4%的生铁多少吨?(假设在冶炼过程中有1%的铁损失)。
五、附加题(10分)
31、将Na和Al共0.5 mol,投入一定量的水中,充分反应后无固体残留物,放出H2 7.84L(标准状况)并得到50mL溶液。试求:
(1)投入水中的Na有______mol;Al有_______mol。
(2)所得溶液中各种离子的物质的量浓度由大到小的顺序是____________________。
(3)向所得溶液中加2 mol·L-1的稀盐酸_________mL时产生的沉淀最多;再继续加入_________mL稀盐酸后沉淀正好完全消失。
(参考答案及评分标准)
一、选择题(每小题只有一个正确选项,每小题2分,共40分。)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | C | B | D | A | D | D | D | D | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | D | A | C | A | B | C | C | C | D |
二、填空题(方程式2分,其余除有说明外每格1分,共40分。下同。)
21、第五主族,N P As Sb Bi,N;增大,减弱,减弱。
22、3、10、3、1、5(2分)(标电子转移略。2分)铁,1.806╳1023(2分)
23、①,②,⑤
|
![]()
![]() 25、
25、
|
水浴;受热均匀,温度易控制;作催化剂;水浴中; 易产生副反应,硝酸分解。
26、Mg2+ Al3+ H+;Mg2+ Al3+ H+;AlO2- OH- Na+;AlO2- OH-;Mg2+ Al3+ H+ Cl-
![]() 27、(1)②2NO + O2
2NO2
27、(1)②2NO + O2
2NO2
![]()
|
![]() ④3O2 22O3
④3O2 22O3
(2)硝酸进入土壤生成硝酸盐被植物吸收,提供氮肥。(其他合理答案也给分,2分)
三、实验题(14分)
|
![]()
![]() 29、(1)
29、(1)
![]() +
Br2
+
HBr
+
Br2
+
HBr
![]() (2)吸收苯与溴蒸汽,浅黄色沉淀,AgNO3 + HBr
AgBr↓ + HNO3
(2)吸收苯与溴蒸汽,浅黄色沉淀,AgNO3 + HBr
AgBr↓ + HNO3
(3)无色油状,溴苯。
四、计算题(6分)
30、(1)88%(0.88)(3分) (2)31.76吨 (3分)
五、附加题(每格2分)
31、(1)0.4;0.1。(2)C(Na+)>C(OH-)>C(AlO2-)>C(H+)(3)200 ;150。