电离平衡同步素质训练试卷
一、选择题 (本题包括10小题,每小题2分,每小题只有一个答案符合题意)
1、下列叙述中正确的是 ( )
A.物质的溶解过程,实质上就是其电离过程
B.二氧化硫的水溶液能导电,所以二氧化硫是电解质
C.1 L 0.1 mol·L-1的H2SO4溶液中含有0.2 mol的H+
D.1 L 0.2 mol·L-1的H2SO3溶液中含有0.2 mol的H+
2、下列电离方程式中,错误的是 ( )
![]() A.Al2(SO4)3===2Al3++3SO42- B.HF H++F-
A.Al2(SO4)3===2Al3++3SO42- B.HF H++F-
![]()
![]() C.HI H++I-
D.Ca(OH)2 Ca2++2OH-
C.HI H++I-
D.Ca(OH)2 Ca2++2OH-
3、下列叙述中,能证明某物质是弱电解质的是 ( )
A.熔化时不导电 B.不是离子化合物,而是极性共价化合物
C.水溶液的导电能力很差 D.溶液中已电离的离子和未电离的分子共存
4、20℃时H2S饱溶液1L,其浓度为0.1mol·L-1,其电离方程式为H2S===H++HS-,HS-===H++S2-,若要使该溶液[H+]及[S2-]都减小,可采取的措施是 ( )
A、加入适量的水 B、加入适量的NaOH固体
C、通入适量的SO2 D、加入适量的CuSO4固体
5、向氨水中加入NH4Cl晶体,溶液的碱性 ( )
A.增强 B.减弱 C.不变 D.为零
6、把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的
是 ( )
A.自来水 B.0.5 mol·L-1盐酸
C.0.5 mol·L-1CH3COOH溶液 D.0.5 mol·L-1KCl溶液
7、下列物质中属于电解质,但在给定条件下不能导电的是 ( )
A.稀硫酸 B.液态溴化氢 C.铝 D.蔗糖
8、将硫酸钾、硫酸铝、硫酸钾铝三种盐混合溶于硫酸酸化的水中,测得c(SO![]() )=
)=
0.105mol·L-1、c(Al3+)=0.055mol·L-1,溶液的pH=2.0(假设溶液中硫酸完全电离
为H+和SO![]() ),则c(K+)为
( )
),则c(K+)为
( )
A.0.045mol·L-1 B.0.035mol·L-1 C.0.055mol·L-1 D.0.040mol·L-1
9、在氢硫酸溶液中c(H+)和c(S2-)的比值是 ( )
A.1 B.2 C.大于2 D.1~2之间
10、化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
![]() HIn(溶液) H+(溶液)+In-(溶液)
HIn(溶液) H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液
①盐酸②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水
其中能使指示剂显红色的是 ( )
A.①④⑤ B.②⑤⑥ C.①④ D.②③⑥
二、选择题(本题包括12小题,每小题3分,共36分。每题有1-2个选项符合题,少选
扣2分,多选、错选均不给分)
11、下列关于电解质电离的叙述中,正确的是 ( )
A.碳酸钙在水中溶解度很小,其溶液的电阻率很大,所以碳酸钙是弱电解质
B.碳酸钙在水中的溶解度很小,但被溶解的碳酸钙全部电离,所以碳酸钙是强电解质
C.氯气和氨气的水溶液导电性都很好,所以它们是强电解质
D.水难电离,纯水几乎不导电,所以水是弱电解质
12、在CH3COOH H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓
度增大,应采取的措施是 ( )
A.加入NaOH B.加入盐酸 C.加水 D.升高温度
13、在硫化氢饱和溶液中,加入适量下列试剂后,不能使溶液的酸性增强的是( )
A.亚硫酸 B.胆矾 C.氯水 D.盐酸
14、下列各组离子,在强碱性溶液中可以大量共存的是 ( )
A.I-、AlO2-、Cl-、S2- B.Na+、K+、NH4+、Ba2+
C.Br-、S2-、Cl-、CO32- D.SO32-、NO3-、SO42-、HCO3-
15、电解质溶液导电能力的强弱决定于( A )
A.溶液中离子的浓度 B.溶液的浓度
C.溶液的体积 D.电解质本身的化学性质
16、1 mol 下列物质,在水中能电离出3 mol 离子的是 ( )
A.H2S B.Fe2(SO4)3 C.Ba(OH)2 D.NaCl
17、下列各式中,属于正确的电离方程式的是 ( )
A.HCO3-
+ H2O ![]() H2CO3 + OH-
B. HCO3- +OH- ==== H2O + CO32-
H2CO3 + OH-
B. HCO3- +OH- ==== H2O + CO32-
C.NH3
+ H+ === NH4+ D.NH3·H2O
![]() NH4+ + OH-
NH4+ + OH-
18、有五瓶溶液分别是①10mL0.60mol·L-1NaOH水溶液,②20mL0.50mol·L-1H2SO4
水溶液,③30mL0.40mol·L-1HCl水溶液,④40 mL 0.30 mol·L-1CH3COOH水溶液,
⑤50 mL 0.20 mol·L-1蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序
是 ( )
A.①>②>③>④>⑤ B.②>①>③>④>⑤
C.②>③>④>①>⑤ D.⑤>④>③>②>①
19、.在同体积0.3 mol·L-1的H2SO4、HCl、HNO3、CH3COOH溶液中,加入足量的Zn,
下列说法中正确的是 ( )
A.硫酸中放出氢气量最多 B.醋酸中放出氢气量最多
C.盐酸中放出的氢气量最多 D.盐酸和硝酸中放出的氢气相等
20、在CH3COOH
![]() H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓
H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓
度增大,应采取的措施是 ( )
A.加入NaOH B.加入盐酸 C.加水 D.升高温度
21、在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离度增大,H+ 浓度减小,可采用
的方法是
A.加热 B.加入0.1mol/L 的醋酸溶液100mL
C.加入少量的0.5mol/L的硫酸 D.加入少量的1mol/L 的NaOH溶液
22、设NA为阿伏加德罗常数,下列说法正确的是
A.1L0.1mol/L的Na2CO3溶液中,含Na+0.2 NA个,CO32-0.1 NA个
B.1L0.3mol/L的K2SO4溶液中,含K+和SO42-离子总数为0.9 NA个
C.2L0.6mol/L的Fe2(SO4)3溶液中,含SO42-离子总数为2.4 NA个
D.0.1mol/L的H3PO4溶液中,[H+]∶[PO43-]<3∶1
三、填空题
23、(15分)为测定冰醋酸在加水稀释的过程中溶液导电能力的变化,某学生用下图所示仪器设计了一个实验。
 |
(1)请将下面所示仪器间没有连接的部分用导线连接起来完成本实验。
(2)电路开关闭合为t0时刻,之后向长颈漏斗中持续加入蒸馏水,并分别在t1、t2、t3时刻观察到电流计指针的偏转情况如下(其中t1<t2<t3,且在实验全过程中,t2时刻电流计指针偏转为最大)
 请据此信息分析,在t1到t2的过程中,溶液中[H+](填“增大”“减小”或“不变”)__________;继续加水,在t2到t3的过程中,溶液中[H+](填“增大”“减小”或“不变”)___________;请用简要文字解释冰醋酸在稀释过程中[H+]变化的原因_____________
请据此信息分析,在t1到t2的过程中,溶液中[H+](填“增大”“减小”或“不变”)__________;继续加水,在t2到t3的过程中,溶液中[H+](填“增大”“减小”或“不变”)___________;请用简要文字解释冰醋酸在稀释过程中[H+]变化的原因_____________
__________________________________________________________________________。
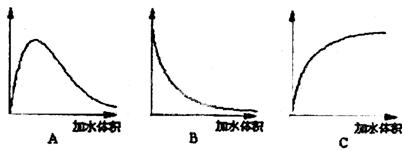
(3)下图中横坐标均表示向一定量冰醋酸中加入水的体积,请判断图中纵坐标的意义并填空。
纵坐标表示(请填选项字母):醋酸的电离度______________;醋酸的浓度__________;溶液的导电能力__________。
24、(6分)向碳酸钠的浓溶液中逐滴加入稀盐酸,到不再产生二氧化碳气体为止。则在
此过程中,溶液中的碳酸氢根离子浓度的变化趋势可能是 (从下面的
选项中选择),
A.逐渐减少 B.逐渐增大
C.先逐渐增大,而后减小 D.先逐渐减小,而后增大
有关反应的离子方程式为 。
25、(4分)1923年化学家Bronsted和Lowry提出.凡是能给出质子的物质都是酸,凡是
能接受质子的物质都是碱。按此理论,下列粒子.①HS-;②NH4+;③HCl;④OH-;
⑤H2PO4-;⑥H2S;⑦CH3COO-;⑧CO32-;⑨HCO3-;⑩H2O 中
属于两性物质的有
26、(9分)下列物质中,能导电的是__________________,属于强电解质的是____________
属于非电解质的是________________(均填序号)
①Cu②液氨③氯水④氯化钠晶体⑤硫酸溶液⑥干冰⑦BaSO4⑧液氧⑨金刚石⑩石墨
27、(10分)化学实验员给某学生提供下列药品和必要的实验仪器,要求学生设计实验,证明醛酸是弱酸。药品为冰醋酸、蒸馏水和PH试纸。此同学思考后认为:
(1)设计的理论依据是_________________________;
(2)实验的简要步骤是__________________________;
(3)需记录的现象和数据是_____________________________;
(4)推断与分析:由于__________________,说明___________________,所以醋酸是弱酸。
1、电离平衡同步素能训练答案
一、选择题 (本题包括10小题,每小题2分,每小题只有一个答案符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | C | D | A | B | B | B | B | C | C |
二、选择题(本题包括12小题,每小题3分,共36分。每题有1-2个选项符合题,少选
扣2分,多选、错选均不给分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| BD | D | A | AC | A | C | D | D | A | D |
| 21 | 22 | ||||||||
| D | B |
三、填空题
 |
23、如图所示:
(2)增大;减小:由于冰醋酸中没有水,醋酸分子无法发生电离,则to时刻[H+]约为零;当加入一定量的水时,醋酸溶液浓度有所减小,但醋酸的电离度增大,导致溶液中[H+]增大;当加入大量的水后,尽管电离度继续增大,但醋酸溶液的减小成为影响[H+]的主要因素,所以溶液中[H+]反而减小。
(3)C;B;A
24、C;CO32- + H+ = HCO3-;HCO3- + H+ = H2O + CO2↑
25、①⑤⑨⑩
26、①③⑤⑩;④⑦;②⑥
27、⑴弱电解质稀释10a倍,pH值改变小a ⑵将一定溶液的醋酸稀释到一定量(如100倍)后,测量稀释前后溶液的pH值 ⑶稀释的倍数,稀释前后溶液的pH值。(4)溶液稀释100倍后,溶液的pH的改变小于2;稀释过程中醋酸的电离度增大