高二年级化学上学期期末考试
化 学 试 题
试卷说明:
1.本试卷满分:100分 ; 答题时间:100分钟
2.本试卷分为第Ⅰ卷和第Ⅱ卷两部分,请把第Ⅰ卷选择题的答案用2B铅笔填涂在答题
卡上,第Ⅱ卷的答案写在答题纸上,考试结束后上交答题纸和答题卡。
3.可能用到的相对原子质量: H:1 C:12 N:14 O:16 Mg:24 Al:27 Cl:35.5 Fe:56
第Ⅰ卷(选择题,共50分)
一、选择题(每小题只有1个选项符合题意,每小题2分,共26分)
1.1828年,一位科学家用无机盐NH4CNO直接制得有机物尿素,填补了无机物与有机物之间的鸿沟,这位科学家是 ( )
A.法拉第 B.维勒 C.德谟克利特 D.道尔顿
2.下列说法正确的是 ( )
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D.天然气、沼气、坑气和水煤气的主要成分都是甲烷
3.把铝条放入盛有过量稀盐酸的试管中,不会影响氢气产生速率的因素是 ( )
A.盐酸的浓度 B.铝条的表面积
C.溶液的温度 D.加少量NaCl固体
4.用食用白醋(醋酸浓度约为1 mol/L)进行下列实验,能证明醋酸为弱电解质的是 ( )
A.白醋中滴入石蕊试液呈红色 B.白醋能够导电
C.蛋壳浸泡在白醋中有气体放出 D.pH试纸显示醋酸的pH为3~4
5.已知:C(s)+CO2(g)![]() 2CO(g)(吸收热量);该反应达到平衡后,下列条件有利于反应向正方向进行的是
( )
2CO(g)(吸收热量);该反应达到平衡后,下列条件有利于反应向正方向进行的是
( )
A.升高温度和减小压强 B.降低温度和减小压强
C.降低温度和增大压强 D.升高温度和增大压强
6.某学生设计一水果电池:他把一铁钉和碳棒用导线连接好,然后将铁钉和碳棒平行插入一新鲜西红柿中 ,再在导线中接一个灵敏电流计。据此下列叙述正确的是 ( )
A.电流计指针不会发生偏转 B.金属铁会被腐蚀
C.碳棒作负极 D.铁表面有气体逸出
7.下列过程或现象与盐类水解无关的是 ( )
A.纯碱溶液去油污
B.加热稀醋酸溶液其pH 稍有减小
C.小苏打溶液与AlCl3溶液混合产生气体和沉淀
D.浓的硫化钠溶液有臭味
8.能正确表示下列反应的离子方程式的是 ( )
A.醋酸钠的水解反应 CH3COO— + H3O+ = CH3COOH + H2O
B.氢硫酸的电离方程式为 H2S ![]() 2H+ +
S2-
2H+ +
S2-
C.氯化铝溶液中滴加过量的氨水 Al3+ + 3NH3·H2O == Al(OH)3↓ + 3NH4+
D.稀硝酸与过量的铁屑反应 3Fe + 8H+ + 2NO3— = 3Fe3+ + 2NO↑ + 4H2O
9.25℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是 ( )
H++OH-,下列叙述正确的是 ( )
A.向水中加入氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
|
A.常温常压下为气体
B.不能使酸性KMnO4溶液褪色
C.光照条件下能够与氯水发生取代反应
D.高温下可以分解
11.下列分子中不含非极性键,且呈空间正四面体结构的是 ( )
A.白磷 B.SiO2 C.NH3 D.CF4
12.用已知浓度的盐酸滴定未知浓度的NaOH溶液,选用酚酞作指示剂,下列操作会导致测定结果偏低的是 ( )
A.酸式滴定管未润洗就装标准液滴定
B.锥形瓶未用待测液润洗
C.读取标准液读数时,滴前仰视,滴定到终点后俯视
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失
13.在重水中存在下述电离平衡:![]()
![]()
![]() ,因此,对重水(
,因此,对重水(![]() )可采用pH一样的定义来规定pD,那么pD=-lg[D+].已知在某温度下D2O达电离平衡时,[D+]×[OD—]=1.6×10—15,则在下列叙述中:①用0.01 mol NaOD和D2O配成1 L溶液,其pD=2;②把0.01 mol
DCl溶于D2O中,配成1 L溶液,其pD=2;③纯净D2O在此温度下的pD大于7;④用D2O配制0.2mol/L FeCl3溶液,溶液中Cl—浓度恰好是Fe3+浓度的3倍.其中说法正确的组合是
( )
)可采用pH一样的定义来规定pD,那么pD=-lg[D+].已知在某温度下D2O达电离平衡时,[D+]×[OD—]=1.6×10—15,则在下列叙述中:①用0.01 mol NaOD和D2O配成1 L溶液,其pD=2;②把0.01 mol
DCl溶于D2O中,配成1 L溶液,其pD=2;③纯净D2O在此温度下的pD大于7;④用D2O配制0.2mol/L FeCl3溶液,溶液中Cl—浓度恰好是Fe3+浓度的3倍.其中说法正确的组合是
( )
A.①② B.①④ C.③④ D.②③
二、选择题(每小题只有1个选项符合题意,每小题3分,共24分)
14.右图是温度和压强对X+Y![]() 2Z反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
( )
2Z反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
( )
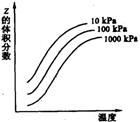 A.X和Y中只有一种为气态,Z为气态
A.X和Y中只有一种为气态,Z为气态
B.X、Y、Z均为气态
C.上述反应的正反应为吸热反应
D.改变压强不能使上述平衡发生移动
15.根据下表中烃的分子式排列规律,判断空格中烃的同分异构体数目是 ( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A.6 B.5 C.4 D.3
16.室温时,下列混合溶液的pH一定小于7的是 ( )
A.pH = 3的盐酸和pH = 11的氨水等体积混合
B.0.1mol/L的盐酸和0.1mol/L的碳酸钠溶液等体积混合
C.0.05mol/L的硫酸和0.1mol/L的氨水溶液等体积混合
D.pH = 3的硫酸和pH =3的氢氧化钡溶液等体积混合
17.用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按图所示步骤分离五种离子,则溶液①、②、③、④分别是 ( )
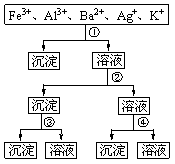
A.①NaCl ②NaOH ③NH3·H2O ④ H2SO4
B.①H2SO4 ②NaOH ③NH3·H2O ④NaCl
C.①H2SO4 ②NH3·H2O ③NaOH ④NaCl
D.①NaCl ②NH3·H2O ③NaOH ④H2SO4
18.下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-)
19.已知Be和 Al在周期表中处于对角线位置 ,性质相似。反应BeCl2 + Na2BeO2 + 2H2O = 2NaCl + 2Be(OH)2↓能完全进行,则下列推断中正确的是 ( )
A.BeCl2溶液的pH<7,将其蒸干并灼烧后,得到的残留物为Be(OH)2
B.Na2BeO2溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
C.Be(OH)2既能溶于盐酸又能溶于烧碱溶液
D.因为BeCl2水溶液的导电性强,所以BeCl2一定是离子化合物
20.一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g)![]() Z(g),经60 s达到平衡,生成0.3 mol
Z,下列说法正确的是 (
)
Z(g),经60 s达到平衡,生成0.3 mol
Z,下列说法正确的是 (
)
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若升高温度Y的转化率减小,则正反应为吸热反应
D.达到平衡时,X与Y 的浓度相等
21.自然界中存在一种尖晶石,化学式为MgAl2O4,它透明色美,可作为宝石。已知该尖晶石中混有Fe2O3。取一定量样品5.4g,与一定浓度100ml盐酸反应恰好使其完全溶解,则盐酸的浓度可能是 ( )
A.0.8 mol/L B.2.8 mol/L C.4.0 mol/L D.4.9 mol/L
|
三、简答题(本题包括5个小题,共33分)
22.(9分)有下列各组物质:
A.金刚石和C60
B.![]() 和
和![]()
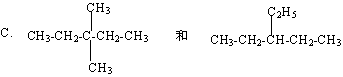

![]()
其中①互为同系物的是 (用A、B、C等序号填写,下同)
②互为同位素的是
③互为同分异构体的是
④互为同素异形体的是
⑤是同一种物质的是
⑥用系统命名法命名选项C中的两种物质: ;
。
23.(6分)科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。
在电池负极上反应的物质为: ;电极反应式为: ;
在电池正极上反应的物质为: ;电极反应式为: ;
24.(6分)常温常压下,由A、B两种气体组成的混合气体,经分析确定,只含碳、氢两种元素,若A、B无论以何种比例混合,碳、氢两种元素的质量比总是小于3:1。若A的相对分子质量比B的相对分子质量大。则A为 ;B为 。若上述混合气体中,碳、氢元素的质量比为3:2,则混合气体中A、B的物质的量之比为 。
25.(6分)下表是某种常见金属的部分性质:
| 颜色状态 | 硬度 | 密度 | 熔点 | 导电性 | 导热性 | 延展性 |
| 银白色固体 | 较软 | 2.70g/cm3 | 660.4℃ | 良好 | 良好 | 良好 |
将该金属投入冷水中无变化,投入稀盐酸中,可产生大量的无色气体。根据上述信息回答:
(1)试推断该金属可能的一种用途_________,该金属的活动性比铜______(填“强”或“弱”)
(2)请自选试剂,设计实验证明你的上述判断(即该金属与铜的活动性关系),并完成下表:
| 验证内容 | 验证方法 | 实验现象 |
| 该金属与铜的活泼性强弱 |
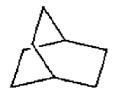
![]() 26.(6分)用“键线式”表示烃分子的结构非常简便、直观。表示式中“以线示键”,即一个碳碳共价键用一个短线来表示,碳原子和氢原子都不表示出来,“线的端点”及“线和线的交点”为一个碳原子,然后根据碳原子的四价饱和,就可以知道每个碳原子上结合的氢原子数目。如:丁烷可以表示为:
.有一种烃,它的键线式如下图,其中任意两个面的夹角为120°,请回答:
26.(6分)用“键线式”表示烃分子的结构非常简便、直观。表示式中“以线示键”,即一个碳碳共价键用一个短线来表示,碳原子和氢原子都不表示出来,“线的端点”及“线和线的交点”为一个碳原子,然后根据碳原子的四价饱和,就可以知道每个碳原子上结合的氢原子数目。如:丁烷可以表示为:
.有一种烃,它的键线式如下图,其中任意两个面的夹角为120°,请回答:
(1)该烃的分子式为: ;
(2)该烃的一氯代物的同分异构体数目为: ;
其二氯代物的同分异构体数目为: ;
(3)1mol 该烃充分燃烧消耗氧气为: mol.
四、实验题(本题包括一个小题,共11分)
27.三氯化铁是中学化学实验室中必不可少的重要试剂。某 同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3•6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a ,关闭b ,从分液漏斗内向A中加过量的稀盐酸,充分反应后溶液呈浅绿色,再打开b 进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3挥发,再降温结晶得FeCl3•6H2O晶体。填写下列空白:
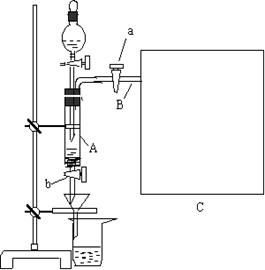 |
(1)滴加盐酸,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是
。
(2)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3•6H2O晶体,而不用直接蒸干溶液的方法来制得晶体的理由 。
(3)用该法制得的晶体中往往混有Fe (NO3) 3,为了制得较纯净的FeCl3•6H2O,可将烧杯内的稀硝酸换成 。
(4)若要求废铁屑的纯度,需要测出从B中排出气体的体积。若测得排出的气体体积为V (已折算成标准状况,单位:L),则废铁屑的纯度为: (用m、V的代数式表示)。
(5)为了测出从B中放出气体的体积V ,请自选仪器在C处设计简便、合理的集气装置,并在下面框格中画出该装置图。(假设所用仪器的体积均足够大)
 |
五、计算题(本题包括1个小题,共6分)
28. AxByCz是由A、B、C三种不同短周期的生活中常见元素组成的化合物。已知(1)x 、y、z均为正整数,且有x+y+z=13.(2)取0.025mol此化合物与过量的水反应,产生1.2g气态物质N ,同时生成0.025mol白色胶状沉淀R,R既能溶于氢氧化钠溶液,又溶于盐酸,但不溶于氨水。(3)同温同压下,40ml 由B、C两元素组成的气态物质N ,完全燃烧需O2为80ml ,燃烧产物中有CO2和H2O。(4) B的原子序数大于C的原子序数。试回答:
(1)写出A、B、C三种元素的名称:A 、B 、C 。
(2)该化合物的化学式为: 。
参考答案
一、选择题(每小题只有1个选项符合题意,每小题2分,共26分)
1.B 2.B 3.D 4.D 5.A 6.B 7.B 8.C 9.B 10.C 11.D
|
二、选择题(每小题只有1个选项符合题意,每小题3分,共24分)
14.C 15.D 16.C 17.D 18.A 19.C 20.A 21.B
第Ⅱ卷(非选择题,共50分)
三、简答题(本题包括5个小题,共33分)
22.(9分)(1)E (2)B(3)C (4)A (5)D (6)3,3-二甲基戊烷 ;3-乙基戊烷
(注:(1)——(5)每空1分;(6)问每空2分)
23.(6分)H2 、(1分)H2 – 2e- = 2H+ (2分);O2、(1分)O2 + 4H+ + 4e- = 2H2O (2分)
24.(6分)答案:CH4 H2 、1:2 (每空2分)
25.(6分)答案:(1)电缆电线、加热器皿等;(1分)强(1分)
(2)(每空2分)(其它合理答案均给分)
| 猜想 | 验证方法 | 实验现象 |
| 该金属与铜活泼性比较 | 将该金属投入到CuCl2溶液中 | 溶液的蓝色逐渐消失 |
26(6分) (1)C8H14 (2)2 、7 (3)11.5 (每小问2分)
四、实验题(本题包括一个小题,共11分)
27.(1)(2分) 铁粉与杂质铜形成原电池反应,加快了反应速率。
(2)(2分) 因为氯化铁是强酸弱碱盐水解生成氢氧化铁和盐酸,加热蒸干时使HCl 挥发造成水解平衡右移,因此得不到FeCl3•6H2O晶体
(3)(2分) 双氧水或新制氯水(填任一个均给满分)
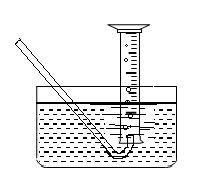 (4)(2分)(250V/m)%
(4)(2分)(250V/m)%
 (5) (3分)
(5) (3分)
( 画出其一即可)
五、计算题(本题包括1个小题,共6分)
28.(1) A:铝 B:碳 C:氢 (3分) (2)AlC3H9 (3分)