高二年级化学下学期月考试卷
(选修3《物质结构与性质》专题1~3)
答题可能需要的相对原子质量:Na:23 Cl:35.5
考试时间:100分钟;试卷总分:120分
一、选择题(单项选择题,共8小题,每小题3分,共24分)
1.科学家对原子结构的认识顺序正确的是
①.道尔顿原子模型 ②.卢瑟福原子模型 ③.汤姆生原子模型 ④.电子云模型
A.①②③④ B.④①②③ C.④②③① D.①③②④
2.某周期ⅡA族元素的原子序数为x,则同周期的Ⅲ族元素的原子序数是
A.只有x+1 B.可能是x+8或x+18
C.可能是x+2 D.可能是x+1或x+11或x+25
3.下列各组元素属于p区的是
A.原子序数为1,2,7的元素 B.O,S,P
C.Fe,Ar,Cl D.Na,Li,Mg
4.下列分子中,所有原子都满足最外层为8电子结构的是
A.BF3 B.NCl3 C.PCl5 D.CHCl3
5.下列物质中不存在氢键的是
A.冰醋酸中醋酸分子之间 B.液态氟化氢中氟化氢分子之间
C.一水合氨分子中的氨分子与水分子之间 D.可燃冰(CH4·8H2O)中甲烷分子与水分子之间
6.下列有关化学键与晶体结构说法正确的是
A.两种元素组成的分子中一定只有极性键 B.离子化合物的熔点一定比共价化合物的高
C.非金属元素组成的化合物一定是共价化合物 D.含有阴离子的化合物一定含有阳离子
7.X是短周期元素构成的某离子化合物,1molX含有20mol电子。下列说法中正确的是
A.晶体中阳离子和阴离子个数一定相等 B.晶体中一定只有离子键没有共价键
C.所含元素一定不在同一周期也不在第一周期 D.晶体中阳离子半径一定大于阴离子半径
8.下面有关晶体的叙述中,不正确的是
A.金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围距离相等的Na+共有6个
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
二、选择题(每小题有1~2个选项符合题意,共6小题,每小题4分,共24分)
9.构造原理揭示的电子排布能级顺序,实质是各能级能量高低顺序.若以E表示某能级的能量,下列能量大小顺序中正确的是
A.E(3s)>E(3p)>E(3d) B.E(3s)>E(2s)>E(1s)
C.E(4f)>E(3d)>E(4s)
D.E(5s)>E(4s)>E(4f)
10.下列表达方式错误的是
A.![]() B.甲烷的电子式
B.甲烷的电子式 ![]()
C.硫离子的核外电子排布式 1s22s22p63s23p4 D.碳-12原子构成 ![]() C
C
11.下列各组原子,彼此性质一定相似的是
A.1s2与2s2的元素
B.M层上有两个电子与N层上有两个电子的元素
C.2p上有一个未成对电子与3p上有一个未成对电子的元素
D.L层上有一个空轨道和M层的p轨道上有一个空轨道的元素
12.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A.X与Y形成化合物时,X显负价,Y显正价 B.第一电离能Y一定小于X
C.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性D.气态氢化物的稳定性:HmY小于HmX
13.下列说法正确的是
A.原子晶体中只存在非极性共价键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
14.最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是
A.该晶体类型是原子晶体
B.该晶体中碳原子和氧原子的个数比为1∶2
C.晶体中碳原子数与C—O化学键数之比为1∶2
D.晶体的空间最小环共有6个原子构成
三、填空题(共36分)
15.(10分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
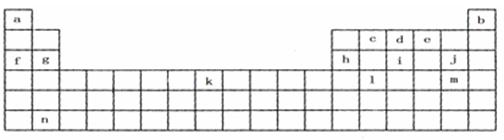
(1)上表所列元素中,原子最外层只有2个电子的短周期元素是(填元素符号) ;
元素j的最高氧化物的化学式为 ,元素i最高氧化物的水化物的化学式为 。
(2)已知与f在同一周期的元素R位于第p主族,则R的原子序数为(用p的代数式表示) ,R能形成气态氢化物,其氢化物的化学式为 。
(3)根据构造原理,写出m原子的外围电子排布式_____________________。
16.(14分)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,C是________,D是________,E是_________。
(2)C、D、E四种元素的简单离子按半径由小到大的顺序为(用离子符号表示)_____________________。
(3)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是
___________。(填﹥、﹤、﹦,用元素符号表示)
(4)用轨道表示式表示D元素原子的价电子构型____________________。
(5)写出A和B按原子个数比1 : 1形成的化合物的电子式 。
(6)用电子式表示D和E形成离子化合物的形成过程 。
17.(12分) 根据图回答问题:
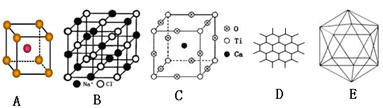
⑴A图是某离子化合物的晶胞(组成晶体的一个最小重复单位),阳离子位于中间,阴离子位于8个顶点,该化合物中阳、阴离子的个数比是 。
⑵B图表示构成NaCl晶体的一个晶胞,通过想像与推理,可确定一个NaCl晶胞中含Na+和Cl-的个数分别为 、 。
⑶钇钡铜复合氧化物超导体有着与钙钛矿型相关的晶体结构,若Ca、Ti、O结构如C图所示的晶体,其化学式为 。
⑷石墨晶体结构如D图所示,每一层由无数个正六边形构成,则平均每一个正六边形所占有的碳原子数为 ,C-C键个数为 。
⑸晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体,如E图所示。其中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察E图,推断这个基本结构单元所含硼原子个数、键角、B-B键的个数依次为 、 、 。
四、填空题:(26分)
18. (8分)随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中。
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积为V cm3。
(1)步骤①中仪器A最好使用 (填序号)。
A.量筒 B.烧杯 C.容量瓶 D.试管
(2)步骤②中是用酸式滴定管还是用碱式滴定管 ,理由是 。
(3)能否用水代替苯 ,理由是 。
(4)已知NaCl晶体中,靠得最近的Na+、Cl—间的距离为a cm(如上图),则用上述方法测得的阿佛加德常数NA的表达式为 。
19.(10分) 现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是 。
(2)元素Y与氢元素形成一种离子YH4+ ,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是_____。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是 _____________ 。
20. (8分)
(1)前三周期元素中第一电离能最小的是 (填元素符号),其基态原子的电子排布式为 。第二周期非金属元素形成的氢化物中化学键极性最大的是 (填分子式),该物质在CCl4中的溶解度比在水中的溶解度 (填“大”或“小”)。
 |
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是 (填物质字母代号)。
(3)晶格能的大小:MgO NaCl,键能的大小:HBr HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
 五、计算(10分)
五、计算(10分)
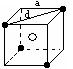
21.(8分)某离子晶体晶胞结构如下图所示,x位于立方体的
顶点,Y位于立方体中心。试分析:
⑴晶体中每个Y同时吸引着__________个X,每个x同时吸引着
__________个Y,该晶体的化学式为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为__________。
(4)设该晶体的摩尔质量为M g·mol—1,晶体密度为ρg·cm—3,阿伏加德罗常数为NA
mol—1,计算此晶体中两个距离最近的X中心间的距离。(单位取“cm”)
高二月考化学选修答题卷
姓名: 班级: 得分:
选择题:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
非选择题:
15.(10分)
(1)元素是(填元素符号) ;元素j的最高氧化物的化学式为 ,元素i最高氧化物的水化物的化学式为 。
(2)R的原子序数为(用p的代数式表示) ,R氢化物的化学式为 。
(3)m原子的外围电子排布式 。
16. (14分)
(1)A是_ _,B是_ _,C是_ _,D是__ _,E是_ __。
(2)简单离子按半径由小到大的顺序为(用离子符号表示)_ _。
(3)B与D的电负性的大小关系是_ __,C与E的第一电离能的大小是_ _。(填﹥、﹤、﹦,用元素符号表示)
(4)用轨道表示式表示D元素原子的价电子构型。
(5)写出A和B按原子个数比1 : 1形成的化合物的电子式 。
(6)用电子式表示D和E形成离子化合物的形成过程 。
17.(12分)
⑴该化合物中阳、阴离子的个数比是 。
⑵一个NaCl晶胞中含Na+和Cl-的个数分别为 、 。
⑶化学式为 。
⑷平均每一个正六边形所占有的碳原子数为 ,C-C键个数为 。
⑸所含硼原子个数、键角、B-B键的个数依次为 、 、 。
18. (8分)
(1)步骤①中仪器A最好使用 (填序号)。
(2)步骤②中是用酸式滴定管还是用碱式滴定管 ,理由是
。
(3)能否用水代替苯 ,理由是 。
(4)已知NaCl晶体中,靠得最近的Na+、Cl—间的距离为a cm(如上图),则用上述方法测得的阿佛加德常数NA的表达式为 。
19. (10分)
(1)最外层共有 种不同运动状态的电子。这种同位素的符号是 。
(2)写出该微粒的电子式 (用元素符号表示)
(3)非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是_____。
(4) ,理由是 _____________ 。
20.(8分)
(1)第一电离能最小的是 (填元素符号),其基态原子的电子排布式为 。
化学键极性最大的是 (填分子式),在CCl4中的溶解度比在水中的溶解度 (填“大”或“小”)。
(2)形成分子间氢键的物质是 (填物质字母代号)。
(3)晶格能的大小:MgO NaCl,键能的大小:HBr HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是
21.(10分)
⑴晶体中每个Y同时吸引着__________个X,每个x同时吸引着__________个Y,该晶体的化学式为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为__________。
(4)计算此晶体中两个距离最近的X中心间的距离。(单位取“cm”)(写出计算过程)
参考答案:
选择题:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| D | D | B | B | D | D | A |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| B | BC | AC | D | BC | B | CD |
15.(1)元素是(填元素符号) He、Mg ;
元素j的最高氧化物的化学式为 Cl2O7 ,元素i最高氧化物的水化物的化学式为 H3PO4或 HPO3 。
(2)R的原子序数为(用p的代数式表示)10+p,R氢化物的化学式为 H8-pR或RH8-p。
(3)m原子的外围电子排布式 4s24p5 。
16. (14分)
(1)A是_H_,B是_O_,C是_Al_,D是__S_,E是_K__。
(2)简单离子按半径由小到大的顺序为(用离子符号表示)_Al3+ <K+ <S2—_。
(3)B与D的电负性的大小关系是_ O>S __,C与E的第一电离能的大小是_ Al>K _。(填﹥、﹤、﹦,用元素符号表示)
(4)用轨道表示式表示D元素原子的价电子构型。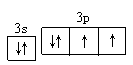

(5)写出A和B按原子个数比1 : 1形成的化合物的电子式 H2O2电子式(略) 。
(6)用电子式表示D和E形成离子化合物的形成过程 K2S形成过程(略) 。
17. (12分)
(1)1:1 (2)4, 4 (3)CaTiO3 ⑷2,3 ⑸ 12 600 30。
18. (8分)
⑴C (2)酸式滴定管;碱式滴定管的橡皮管会溶于苯而变形
(3)否; 水会溶解NaCl,不能准确测出NaCl固体的体积
(4)NA=![]() (每小题2分)
(每小题2分)
19.(10分)
(A)(1)6;![]() 。 (2)
。 (2) 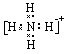 。
(3)Cl; b。
(4)H2CO3; 弱酸性或非氧化性酸(合理即给分)。
。
(3)Cl; b。
(4)H2CO3; 弱酸性或非氧化性酸(合理即给分)。
20.(8分)
(1)Na 1S22S22P63S1 HF 小 (各1分)
(2)B 1分 (3)> > 各1分 (4)B (1分)
21.(10分)
(1)4 8 XY2(或Y2X) (2)12 (3)109°28'
(以上各小题每空均1分,共5分)
(4)(5分)解:一个晶胞中含有![]() 个X和1个Y
个X和1个Y
 m(晶胞)=
m(晶胞)=![]() m(XY2)=
m(XY2)=![]() ·= g
·= g
V(晶胞)= a3 = = = cm3
设此晶体中两个距离最近的X中心间的距离为d(如图所示),则
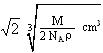 d =
d =![]() a =
a =