2003-2004学年度上学期
高中学生学科素质训练
高二化学同步测试(11)—铁和铁的化合物、原电池
一、选择题 (本题包括10小题,每小题2分,每小题只有一个答案符合题意)
1.2002年由德、法、美及波兰等多国科学家组成的科研小组合成了非常罕见的![]() 原子,有关Fe的说法正确的是 ( )
原子,有关Fe的说法正确的是 ( )
A.它是一种新元素 B.它是一种新核素
C.![]() 与
与![]() 互为同素异形体 D.这种铁原子发生衰变放出两个质子后变成
互为同素异形体 D.这种铁原子发生衰变放出两个质子后变成![]()
2.希尔实验是将分离出的叶绿素加到草酸铁溶液中,经光照后发生反应.
4Fe3++2H20
![]() 4Fe2++4H++02↑下列有关该实验的说法不正确的是 ( )
4Fe2++4H++02↑下列有关该实验的说法不正确的是 ( )
A.反应后溶液的pH降低 B.每生成1mol02转移4mol电子
C.叶绿体被氧化 D.该实验可说明光合作用产生的氧气来源于水
3.Fe(NO3)2溶液呈浅绿色,其中存在下列平衡.![]() ,往该溶液中逐滴加入盐酸,发生的变化是 ( )
,往该溶液中逐滴加入盐酸,发生的变化是 ( )
A.平衡向正反应方向移动 B.平衡向逆反应方向移动
C.溶液颜色由浅绿色变为棕黄色 D.溶液由浅绿色变为灰绿色
4.随着人们生活不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是 ( )
A.利用电池外壳的金属材料
B.回收其中的石墨电极
C.防止电池中的汞、镉和铅等重金属离子对土壤和水的污染
D.不使电池中渗泄的电解液腐蚀其它物品
5.下列装置中能够发生原电池反应的是 ( )
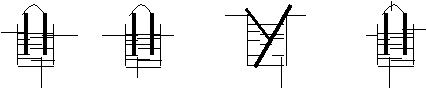
![]()
Cu Cu Al Pt Zn Cu Zn Cu
A.H2SO4 B.NaOH C.HCl D.NaCl
6.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为 2FeCl3 + Cu = 2FeCl2 + CuCl2
向盛有氯化铁溶液的烧杯 同时加入铁粉和铜粉,反应结束后,下列结果不可能出现
的是 ( )
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
7.测知由Fe2(SO4)3和FeSO4组成的混合物中含硫a%,则其含铁量应为 ( )
A.(100-4a)% B.(100-2a)% C.(100-a)% D.(100-3a)%
8.下列反应能生成Fe3+的化合物的是.
①过量Fe与HNO3 ②铁丝在硫蒸气中燃烧 ③向FeBr2溶液中通入Cl2
④铁与CuCl2溶液反应 ⑤Fe(OH)2露置在空气中
A.①②③ B.①③⑤ C.③④ D.③⑤
9.有一块铝铁合金溶于足量的盐酸中,再用过量的氢氧化钠溶液处理,将产生的沉淀过
滤,洗涤、干燥、灼烧,完全变成红色粉未,经称量红色粉末和合金的重量恰好相等,
则合金中铝的质量分数为 ( )
A.30% B.47.6% C.52.4% D.70%
10.南级考查队在印度洋发现了一种不寻常的狗鱼,它的血像水一样无色透明。研究发现这种鱼的血液中某种元素的含量是其它鱼的血液中的十分之一。这种元素是 ( )
A.Cu B.Ag C.Fe D.Pb
二、选择题(本题包括12小题,每小题3分,共36分。每题有1-2个选项符合题,少选
扣2分,多选、错选均不给分)
11.下列各组离子,因发生氧化还原反应,在溶液中不能大量共存的是 ( )
A.Fe3+、Fe2+、SCN-、Cl- B.Fe3+、K+、H+、I-、
C.Fe2+、H+、OH-、Cl-、 D.Fe2+、K+、MnO4-、H+
12.下列化合物中不能由单质直接化合而得到的是 ( )
A.FeCl2 B.Al2S3 C.CuCl2 D.Mg3N2
13.由锌、铁、镁、铝四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是 ( )
A.锌 B.铁 C.铝 D.镁
14.向某晶体的溶液中加入Fe2+的溶液无明显变化,当滴加几滴溴水后,混合液出现血
红色,由此得出的下列结论错误的是 ( )
A.Fe3+的氧化性比溴的氧化性强 B.该晶体中一定含有SCN-
C.Fe2+不能与SCN-形成血红色化合物 D.Fe2+被溴氧化成Fe3+
15.以下现象与电化腐蚀无关的是 ( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.锈质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗
16.下列离子方程式正确的是 ( )
A.铁粉撒入稀硫酸中.2Fe + 6H+ = 2Fe3+ + 3H2↑
B.向氯化铁溶液中通入H2S气体.2Fe3+ + 3H2S = 2FeS↓ + S↓ + 6H+
C.溴化亚铁溶液中通入足量的氯气.2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 6Cl- + 2Br2
D.氢氧化铁溶于氢碘酸溶液中.Fe(OH)3 + 3H+ = Fe3+ + 3H2O
17.今有下列三个氧化-还原反应.①2FeCl3+2KI=2FeCl2+2KCl+I2,
②2FeCl2+Cl2= 2FeCl3,③2KMnO4+16HCl=2KCl+2MnCl2+8H2O+5Cl2↑,
若某溶液中有Fe2+、I-和Cl-共存,若要除去I-,而不影响Fe2+和Cl-,可加入的试
剂是 ( )
A.FeCl3 B.Cl2 C.KMnO4 D.HCl
18.某原电池总反应离子方程式为.2Fe3++Fe=3Fe2+ ,不能实现该反应的原电池是( )
A.正极为铜,负极为铁,电解质溶液为FeCl3 溶液
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3 溶液
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3 溶液
D.正极为银,负极为铁,电解反溶液为CuSO4 溶液
19.将铜粉和铁粉的混合物放入一定量的稀硝酸中微热,反应完毕后发现铜有剩余,则
溶液中含有的金属离子是 ( )
A.Cu2+ Fe3+ B.Cu2+ Fe3+ Fe2+ C.Fe2+ Fe3+ D.Cu2+ Fe2+
20.由铜、锌和稀硫酸组成的原电池工作时,电解质溶液的pH如何变化 ( )
A.不变 B.先变小后变大 C.逐渐变大 D.逐渐变小
21.把含有氧化铁的铁片投入到足量的稀硫酸中,直到铁片完全溶解,经分析该溶液中
无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为3︰1,则原混合物中Fe2O3
与Fe的物质的量之比为 ( )
A.1︰1 B.2︰5 C.4︰1 D.3︰1
22.某稀溶液中含有Fe(NO3)3 、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为 ( )
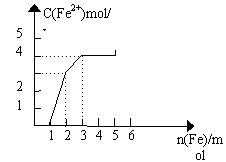 A.1:1:1 B.1:3:1 C.3:3:8 D.1∶:1:4
A.1:1:1 B.1:3:1 C.3:3:8 D.1∶:1:4
三、填空题
23.(13分)(2003年全国高考理综)用下面两种方法可以制得白色的Fe(OH)2沉淀
方法一.用不含Fe2+的FeSO4溶液与用不含O2的
 蒸馏水配制的NaOH溶液反应制备。
蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时
还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含
O2的NaOH溶液,插入FeSO4溶液液面下,再挤
出NaOH溶液。这样操作的理由是 。
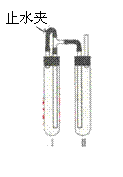
方法二.在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是
。
24.(3分)录像用的高性能磁带的磁粉,主要材料之一是三种元素组成的化学式为
CoxFe3-xO3+x的化合物。已知氧为-2价,钴(Co)和铁可能呈现+2或+3价,且上述化
合物每种元素都只有一种化合价,则x值为_______,铁的化合价为______,钴的
化合价为________。
25.(4分)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰
酸钾更强,本身在反应中被还原为Fe3+
⑴配平制取铁酸钠的化学方程式.
___ Fe(NO3)3 + ____ NaOH + ___ Cl2 ------ Na2FeO4 + ____ NaNO3 + ____ NaCl + ___ H2O
反应中_______元素被氧化,转移电子数目为______
26.(6分)在铁与铜的混合物中,加入一定量的稀硝酸,充分反应后剩余金属m1g;再向其中加入一定量的稀硫酸,充分反应后,剩余金属m2g。则m1和m2之间的关系是 ,原因是 。
|
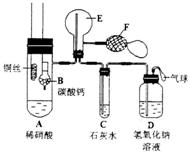
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为_______.
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为_______________________________________________;装置E中开始时出现浅红棕色气
体,用F向E中鼓入空气后,可观察到烧并E内气体颜色加深,产生上述现象的原因是___________________。一段时间后,C中白色沉淀溶解,其原因是______________;
(3)装置D的作用是________________________________________.
四、计算题(9分)
28.在100 mL FeBr2溶液中,通入2.24L标准状况下的氯气,充分反应后,溶液中有![]() 的Br-被氧化成溴单质。求原FeBr2溶液的物质的量浓度?
的Br-被氧化成溴单质。求原FeBr2溶液的物质的量浓度?
29.在500 mL CuSO4和Fe2(SO4)3的混合物中加入21.7g铁粉,待反应完全后,得到16.8g
残留固体。在滤液中加入400 mL 4mol/L的BaCl2溶液,恰好使溶液中的SO42-完全
沉淀。求原混合液中CuSO4和Fe2(SO4)3的物质的量浓度?
参考答案
一、选择题 (本题包括10小题,每小题2分,每小题只有一个答案符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | A | C | C | C | B | D | D | A | C |
二、选择题(本题包括12小题,每小题3分,共36分。每题有1-2个选项符合题,少选
扣2分,多选、错选均不给分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| BD | A | C | A | D | C | A | CD | D | C |
| 21 | 22 | ||||||||
| B | D |
三、填空题
23、(1)稀H2SO4铁屑 煮沸 (3)避免生成的Fe(OH)2沉淀接触O2
方法二(1)稀H2SO4铁屑 (2)NaOH溶液 (3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹. (4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
24、1;+3;+2
25、2 16 3 2 6 6 8
26、m,一定大于m2,原因是.原溶液中剩余有NO3-,加入稀H2SO4后,无论剩余金属是铜或铁和铜的混合物,都会将继续再溶解。
27.(共9分)
(1)用碳酸钙与稀硝酸反应产生的二氧化碳气赶走装置内的空气(2分);
(2)![]() (2 分);
(2 分);
CO2比空气重,从长管进入E,并没有把E中空气赶尽,致使部分NO先与未赶尽的空气生成少量红棕色NO2,当再从F鼓入空气时,E中有更多NO2生成,所以红棕色加深(2分);
二氧化氮与水反应有硝酸生成,硝酸与碳酸钙反应使沉淀溶解(2分);
(3)吸收NO、NO2、CO2尾气,防止污染大气(1分)。
28、1.2mol/L
29、c(CuSO4) = 2.45 mol/L;c[Fe2(SO4)3]= 0.25 mol/L