2003-2004学年度上学期
高中学生学科素质训练
高二化学同步测试(4)—氧化还原反应
一、选择题 (本题包括10小题,每小题2分,每小题只有一个答案符合题意)
1.单质X和Y相互反应生成化合物X2+Y2-,下列叙述中正确的是 ( )
①X被氧化 ②X是氧化剂 ③X具有氧化性 ④XY既是氧化产物又是还原产物
⑤XY中的Y2-具有还原性 ⑥XY中的X2+具有氧化性
⑦Y的氧化性比XY中的X2+的氧化性强
A.①④⑤⑥⑦ B.①③④ C.②④⑤ D.①②⑤⑥⑦
2.已知在某温度时发生如下三个反应.
①C + CO2 = 2CO;②C + H2O = CO + H2 ③CO + H2O = CO2 + H2
由此可判断,在该温度下,C、CO、H2的还原性的顺序 ( )
A.CO﹥C﹥H2 B.C﹥CO﹥H2 C.C﹥H2﹥CO D.CO﹥H2﹥C
3.下列反应中,氧化剂与还原剂的物质的量比为1.2的是 ( )
A.Fe+2FeCl3 =3FeCl2 B.3Cl2+6KOH =5KCl+KClO3+3H2O
C.3C+SiO2 =SiC+2CO D.3S+6KOH =2Na2S+Na2SO3+3H2O
4.下列各组物质中,通常都可作为还原剂使用的是 ( )
A.SO2、H2SO4 B.Cl2、FeCl3 C.H2、CO D.Br2、HNO3
5.下列物质中,与水反应时H2O作为还原剂的是 ( )
A.Na B.Na2O2 C.NO2 D.F2
6.已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化. ( )
Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO3→NO。
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是 ( )
A.Fe3+ B.MnO4- C.Cl2 D.HNO3
7.将NO3-+Zn+OH-+H2O→NH3+Zn(OH)42- 配平后,离子方程式中H2O的系数是( )
A.2 B.4 C.6 D.8
8.下列离子在溶液中因发生氧化还原反应而不能大量共存的是 ( )
A.H3O+、NO3-、Fe2+、Na+ B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42- D.Cu2+、NH4+、Br-、OH-
9.将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时收集到气体1.12L(标准状况)。
则所消耗硝酸的物质的量是 ( )
A.0.12 mol B.0.11 mol C.0.09 mol D.0.08 mol
10.0.1mol·L-1H2C2O4 40ml恰好将4×10-3mol的VO2—还原,则在还原产物VO2n—中n
的值为 ( )
A.5 B.4 C.3 D.2
二、选择题(本题包括12小题,每小题3分,共36分。每题有1-2个选项符合题,少选
 扣2分,多选、错选均不给分)
扣2分,多选、错选均不给分)
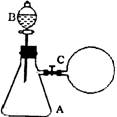
11.如图所示,在支管锥形瓶A中充满等体积的H2S和NO气体;在分液
漏斗中盛有碘化钾溶液;在锥形瓶的支管处用橡胶管连接一个盛有O2
的气囊C(与锥形瓶的体积约相等),用铁夹夹紧。当加入碘化钾溶液
后,再打开铁夹并震荡锥形瓶,下列各化学方程式肯定不符合化学事实
的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
12.从某些性质看,(CN)2与Cl2;NH3与H2O;NH4+与H3O+;NH2-与OH-各组内两两相似,由此判断下列方程式表示的反应中正确的是 ( )
(1)![]() (2)
(2)![]()
(3)![]() (4)
(4)![]()
A.只有(1)(2) B.只有(1)(4) C.只有(3)(4) D.都正确
13.氢阴离子(H-)能与NH3反应.H- + NH3 = NH2- + H2↑。根据上述反应事实可以得
出的正确的结论是 ( )
A.NH3具有还原性 B.H-是很强的还原剂
C.该反应的还原产物是H2 D.该反应属于置换反应
14.下列反应中,两种物质中的同种元素发生氧化还原反应的是 ( )
A.2Na2O2+2H2O=4NaOH+O2↑ B. H2S+H2SO4(浓)=S↓+SO2↑+2H2O
C.KClO3+6HCl=KCl+3Cl2↑+3H2O D. NH3+HNO3=NH4NO3
15.鉍酸钠(NaBiO3)在酸性溶液中可以把Mn2+氧化成MnO4-,在调节该溶液酸性时,不
应选用的酸是 ( )
A.稀硫酸 B.浓盐酸 C.稀硝酸 D.稀盐酸
16.某单质跟浓硝酸反应,若参加 反应的单质与硝酸的物质的量之比为1.4,则该单
质的元素在反应产物中的化合价为 ( )
A.+1 B.+2 C.+3 D.+4
17.未经干燥的容器中通入SO2与H2S共1mol,充分反应后,所得的氧化产物比还原产
物多8g,则通入的SO2和H2S的物质的量之比可能是 ( )
A.1.1 B.1.2 C.2.1 D.1.3
18.硝酸与CuS发生反应为CuS + HNO3 - Cu(NO3)2 + NO2↑+ S↓+2H2O,配平后可知
8mol硝酸参加 反应实际得到的电子数是 ( )
A.1.448×1025个 B.2.408×1024个 C.7.260×1024个 D.1.806×1025个
19.在xR2++yH++O2=mR3++nH2O 的离子方程式中,对化学计量数m和R3+判断正确的是.
A.m=4,R3+是氧化产物 B.m=2y,R3+是氧化产物
C.m=2,R3+是还原产物 D m=y,R3+是还原产物
20.一定条件下硝酸铵受热分解的未配平化学方程式为.NH4NO3 — HNO3 + N2 + H2O,
在反应中被氧化与被还原的氮原子数之比为 ( )
A.5.3 B.5.4 C.1.1 D.3.5
21.关于下列反应的配平系数中,正确的是 ( )
KMnO4+H2O2+H2SO4-K2SO4+MnSO4+O2↑+H2O
A. 2 3 3 1 2 4 6 B.2 5 3 1 2 5 8 C. 2 7 3 1 2 6
10 D.2 9 3 1 2 7 12
22.化学方程式.aFeS+bH2SO4(浓)=cFe(SO4)3+dSO2↑+eS↓+fH2O中,a、b数值是 ( )
A. 2、6 B.3、8 C.14、3 D.6、8
三、填空题
23.(8分)近年来新闻媒介不断报导有人误将亚硝酸钠当食盐食用,发生中毒,甚至死亡事件。NaNO2在酸性介质中可以还原MnO4-,也可以将I-氧化成I2,为了区别食盐和亚硝酸钠应从下表选择哪些试剂?进行哪些操作?根据哪些现象判断是食盐还是亚硝酸钠?将表中的序号填入空白中:
| 试剂 | 操作 | 发生的现象 |
| ① H2SO4 ② KMnO4 ③ KI ④ AgNO3 ⑤ 淀粉溶液 | A、把样品放入碘化钾的硫酸溶液后,再滴加淀粉溶液 B、把样品放入KMnO4的硫酸溶液中 C、把样品放入水中,溶解后加入AgNO3溶液 D、把样品放入盐酸中,再加AgNO3 溶液 | 甲:生成白色沉淀 乙:溶液显蓝色 丙:溶液紫色褪去 |
(1)根据选用试剂_______,进行_______操作,有_________现象发生,可以判断被检的样品是____________。
(2)根据选用试剂_______,进行_______操作,有_________现象发生,可以判断被检的样品是____________。
(3)根据选用试剂_______,进行_______操作,有_________现象发生,可以判断被检的样品是____________。
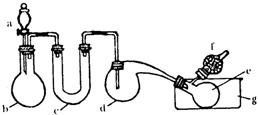
24.(12分)用下图装置(酒精灯、铁架台等没有画出)制取三氯化磷,在d中放入足量的白磷,将氯气迅速而不间断地通入d中,氯气与白磷就会发生反应,产生火焰。其三氯化磷和五氯化磷的物理常数如下:
熔点 沸点
三氯化磷 -112℃ 76℃
五氯化磷 148℃ 200℃分解
(1)若在b中装入MnO2,则a中应装
入__________。在整个装置中___________仪器需要加热(填写仪器对应的字母)。
(2)e仪器的作用是___________,在g中盛放冷水的目的是_____________。
(3)PCl3遇水剧烈反应,c中装入的物质是__________,其目的是_____________。
(4)先在d中底部放入少量细砂,然后放入完全除去了水分的白磷。请回答:为什么要在d中放入少量细砂?
(5)f中碱石灰的作用是_______________________。
(6)如果要除去Cl2中的HCl,实验装置应作何改进?
25.(6分)在KNO3K2O + NO + O2↑反应中,氧化产物是______,还原产物
是______,两者物质的量之比是__________
26.(4分)将NaBiO3固体(黄色、微溶)加入MnSO4和H2SO4的混合溶液里加热,溶液显
紫色(Bi3+无色)。配平该反应的下列离子方程式.
___NaBiO3+___Mn2++
___H+![]() ___Na++
___Bi3+ + ___ _______ + ___ _________
___Na++
___Bi3+ + ___ _______ + ___ _________
常温下,高锰酸钾与盐酸反应可生成氯气,同时MnO4-被还原成Mn2+,写出这一反应的
离子方程式_______________________________________________________。
27.(6分)在3BrF3+5H2O=HBrO3+ Br2+9HF+O2↑的反应中,当有5mol水被氧化时,则
(1)被还原的BrF3的物质的量为______________
(2)被水还原的BrF3的物质的量为 __________
(3)反应中电子共转移了____________
四、计算题 (8分)
28.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧
化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其
中N均为-3价).KCN+2KOH+Cl2 → KOCN+2KCl+H2O
被氧化的元素是 。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目.
□KOCN+□KOH+□Cl2 → □CO2 + □N2 + □KCl + □H2O
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。
参考答案
一、选择题 (本题包括10小题,每小题2分,每小题只有一个答案符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | B | C | C | D | B | C | A | B | C |
二、选择题(本题包括12小题,每小题3分,共36分。每题有1-2个选项符合题,少选
扣2分,多选、错选均不给分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | D | BC | BC | BD | BD | AD | B | A | A |
| 21 | 22 | ||||||||
| B | A |
三、填空题
23、答案;(1)①;C;甲;食盐 (2)①②;b;丙;亚硝酸钠
(3)①③⑤;a;乙;亚硝酸钠
24、答案:(1)浓盐酸 b (2)收集三氯化磷 冷凝三氯化磷 (3)无水氯化钙 干燥氯气 (4)因为氯气与白磷反应产生大量的热,故人少量的细砂可避免d因局部过热而炸裂 (5)除去剩余的氯气,防止污染空气;同时也防止空气中的水蒸气进入,中与PCl3,反应 (6)在b与c之间接一个洗气瓶,瓶内盛饱和食盐水。
25、O2;NO;3.4
26、5 2 14 5 5 2MnO4- 7H2O
2MnO4- + 10Cl- + 16H+ = 2Mn2+ + 5Cl2↑+ 8H2O
27、⑴5 mol
⑵![]() mol
⑶15
mol
mol
⑶15
mol
28、⑴C ⑵2 4 3 2 1 6 2 ⑶35.5