2003-2004学年度上学期
高中学生学科素质训练
高二化学同步测试(6)—化学平衡
一、选择题 (本题包括10小题,每小题2分,每小题只有一个答案符合题意)
1.可逆反应达到平衡的重要特征是 ( )
A.反应停止了 B.正逆反应的速率均为零
C.正逆反应都还在继续进行 D.正逆反应的速率相等
![]() 2.某温度下,在一容积可变的容器中,反应2A(g)+B(g)
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是(2003年全国理综) ( )
2.某温度下,在一容积可变的容器中,反应2A(g)+B(g)
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是(2003年全国理综) ( )
A.均减半 B.均加倍 C.均增加1 mol D.均减少1 mol
3.在一定条件下,反应A2(g)+B2(g) ![]() 2AB(g)达到平衡状态的标志
2AB(g)达到平衡状态的标志
是 ( )
A.单位时间内生成n mol A2的同时,生成n mol的AB
B.容器内的总压强不随时间而变化
C.单位时间内生成2n mol AB的同时,生成n mol的B2
D.单位时间内,生成n mol A2的同时,生成n mol的B2
4.把HI气体充入密闭容器中,在一定条件下发生反应.
2HI(g)
![]() H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说
H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说
法正确的是 ( )
A.HI的生成速率等于其分解速率
 B.HI的生成速率小于其分解速率
B.HI的生成速率小于其分解速率
C.HI的生成速率大于其分解速率
D.无法判断HI的生成速率和分解速率的相对大小
5.反应2X(g)+Y(g)
![]() 2Z(g)+热量,
2Z(g)+热量,
在不同温度(T1和T2)及压强(p1和p2)下,产物Z的
物质的量[n(Z)]与反应时间(t)的关系如图
2—16所示。则下述判断正确的是 ( )
A.T1<T2,p1<p2 B.T1<T2,p1>p2
C.T1>T2,p1>p2 D.T1>T2,p1<p2
6.压强变化不会使下列化学反应的平衡发生移动的是 ( )
A.H2(气)+I2(气) ![]() 2HI(气) B. 3H2(气)+N2(气)
2HI(气) B. 3H2(气)+N2(气) ![]() 2NH3(气)
2NH3(气)
C.2SO2(气)+O2(气) ![]() 2SO3(气) D. C(固)+CO2(气)
2SO3(气) D. C(固)+CO2(气) ![]() 2CO(气)
2CO(气)
7.在容积相同的A、B两个密闭容器中,分别充入2 mol SO2和1 mol O2,使它们在相同
温度下发生反应.2SO2+O2 ![]() 2SO3,并达到平衡,在反应过程中,若A容器保持
2SO3,并达到平衡,在反应过程中,若A容器保持
体积不变,B容器保持压强不变,当A中的SO2的转化率为25%时,则B容器中SO2
的转化率应是 ( )
A.25% B.﹥25% C.﹤25% D.12.5%
8.同温同压下,当反应物分解了8%时,总体积也增加8%的是 ( )
A.2NH3(g) ![]() N2(g)+3H2(g) B.2NO(g)
N2(g)+3H2(g) B.2NO(g) ![]() N2(g)+O2(g)
N2(g)+O2(g)
C.2NO3(g) ![]() 4NO2(g)+O2(g) D.2NO2(g)
4NO2(g)+O2(g) D.2NO2(g) ![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
 9.图2—5中的曲线是表示其他条件一定时,
9.图2—5中的曲线是表示其他条件一定时,
2NO+O2 ![]() 2NO2 放出热量。反应中NO的转化率与
2NO2 放出热量。反应中NO的转化率与
温度的关系曲线,图中标有a、b、c、d四点,其中表示
未达到平衡状态,且v(正)>v(逆)的点是 ( )
A.a点 B.b点 C.c点 D.d点
10.已经建立化学平衡的某可逆反应,当改变条件使平衡向
正反应方向移动时,下列有关叙述中正确的是 ( )
A.生成物的质量分数一定增加 B.生成物的物质的量一定增加
C.反应物的转化率一定增加 D.反应物的浓度一定降低
二、选择题(本题包括12小题,每小题3分,共36分。每题有1-2个选项符合题,少选
扣2分,多选、错选均不给分)
11.下列哪种说法可以证明反应.N2+3H2 ![]() 2NH3已达到平衡状态 ( )
2NH3已达到平衡状态 ( )
A.1个N≡N键断裂的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有6个N—H键断裂
 D.1个N≡N键断裂的同时,有6个N—H键形成
D.1个N≡N键断裂的同时,有6个N—H键形成
12.14.在一定温度下,容器内某一反应中M、N的物
质的量随反应时间变化的曲线如图,下列表述中正确
的是 ( )
A.反应的化学方程式为.2M![]() N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
13.在一密闭容器中,反应 aA(气)![]() bB(气)
bB(气)
达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原
来的60%,则 ( )
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.a>b
14.下列事实中不能应用勒沙特列原理来解释的是 ( )
A.向H2S水溶液中加入NaOH有利于S2-增多
B.加入催化剂有利于氨的氧化反应
C.高压对合成氨有利
D.500℃左右比室温更有利于合成氨的反应
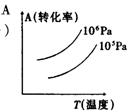 15.有一化学平衡mA(g)+nB(g)
15.有一化学平衡mA(g)+nB(g)
![]() PC(g)+qD(g),右图表示的
PC(g)+qD(g),右图表示的
转化率与压强、温度的关系。由此得出的正确结论是(
A.正反应是吸热反应,(m+n)>(p+q)
B.正反应是吸热反应,(m+n)<(p+q)
C.正反应是放热反应,(m+n)>(p+q)
D.正反应是放热反应,(m+n)<(p+q)
16.将固体NH4I置于密闭容器中,在某温度下发生下列反应.
NH4I(s)![]() NH3(g)+HI(g),2HI(g)
NH3(g)+HI(g),2HI(g) ![]() H2(g)+I2(g)。当反应达
H2(g)+I2(g)。当反应达
到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则NH3的浓度为( )
A.3.5 mol·L-1 B.4 mol·L-1 C.4.5 mol·L-1 D.5 mol·L-1
17.可逆反应.3A(气)==3B(?)+C(?) 吸收热量,随着温度升高,气体平均相对分子质
量有变小趋势,则下列判断正 确的是 ( )
A.B和C可能都是固体 B.B和C一定都是气体
C.若C为固体,则B一定是气体 D.B和C可能都是气体
18.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反
应:A+3B![]() 2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气
2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气
体的体积占10%,下列推断正确的是 ( )
①原混和气体的体积为1.2V升 ②原混和气体的体积为1.1V升;
③反应达平衡时气体A消耗掉0.05V升; ④反应达平衡时气体B消耗掉0.05V升;
A.②③ B.②④ C.①③ D.①④
19.对已达化学平衡的下列反应 2X(g)+Y(g)![]() 2Z(g)
2Z(g)
减小压强时,对反应产生的影响是 ( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
 B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
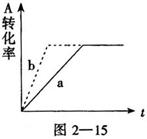
20.已知某可逆反应在密闭容器中进行.
A(g)+2B(g) ![]() C(g)+D(s)放出热
C(g)+D(s)放出热
量,图中曲线a代表一定条件下该反应的过程。若使a
曲线变为b曲线,可采取的措施是 ( )
A.增大A的浓度 B.缩小容器的容积
C.加入催化剂 D.升高温度
21.对于mA(g)+nB(g) ![]() pC(g)+qD(g)的平衡体系,当升高温
pC(g)+qD(g)的平衡体系,当升高温
度时,体系的平均相对摩尔质量从26变为29,则下列说法正确的是 ( )
A.m+n>p+q,正反应是放热反应 B.m+n>p+q,正反应是吸热反应
C.m+n<p+q,逆反应是放热反应 D.m+n<p+q,逆反应是吸热反应
22.在密闭容器中,进行下列反应.
2A(g)+B(g)+C(s) ![]() D(g)+E(g) 吸收热量
D(g)+E(g) 吸收热量
达到平衡后,下列说法中正确的是 ( )
A.若恒温定容情况下,充入一些稀有气体压强增大,但平衡不移动
B.若恒温定压条件下,加入C(g),则B的转化率将增大
C.若定容升温,在新平衡体系中A的质量分数将减小
D.在温度、压强和容积都相同时,在另一密闭容器中加入2 mol A、1 mol B、1 molC,
平衡时两个容器中D和E的浓度分别相等
三、填空题
23.(9分)将等物质的量的A、B、C、D四种物质混和,发生如下反应: aA+bB![]() cC(固)+dD
cC(固)+dD
当反应进行一定时间后,测得A减少了n摩,B减少了![]() n摩,C增加了
n摩,C增加了![]() n摩,D
n摩,D
增加了n摩,此时达到化学平衡:
(1)该化学方程式中各物质的系数为 :a =______、b=________、c=______、d=______。
(2)若只改变压强,反应速度发生变化,但平衡不发生移动,该反应中各物质的聚集状态:
A___________、B__________、C____________、D________________
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为
__________________反应(填“放热”或“吸热”)
24.(9分)化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡.
NH3+H2O ![]() NH3·H2O
NH3·H2O ![]() NH4++OH-
NH4++OH-
(1)向氨水中加入MgCl2固体时,平衡向__________移动,OH-的浓度__________,
NH4+的浓度_____。
(2)向氨水中加入浓盐酸,平衡向___________移动,此时溶液中浓度减小的粒子有
___________、___________、___________。
(3)向浓氨水中加入少量NaOH固体,平衡向______移动,此时发生的现象 __________。
25.(6分)在某固定容积的密闭容器中,存在下列化学平衡.
aA(g)
![]() bB(g)+cC(g),在温度不变的条件下,向容器中再充入
bB(g)+cC(g),在温度不变的条件下,向容器中再充入
一定量的A物质,重新达到平衡时,判断在下列情况下有关物质量的变化趋势
(在下列空白中填写“增大”“减小”或“不变”)
(1)当a=b+c时,B的物质的量分数___________。
(2)当a>b+c时,A的物质的量分数___________。
(3)当a<b+c时,A的转化率___________。
26.(8分)在一定温度下,把2 mol SO2和1 mol O2通入一个一定容积的密闭容器里,发
生如下反应.2SO2+O2 ![]() 2SO3,当此反应进行到一定程度时,反应混合物
2SO3,当此反应进行到一定程度时,反应混合物
就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入
的SO2、O2和SO3的物质的量(mol)。如果a、b、c取不同的数值,它们必须满足一
定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平
衡时完全相同。请填写下列空白.
(1)若a=0,b=0,则c= 。
(2)若a=0.5,b= 和c= 。
(3)a、b、c取值必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,
另一个只含b和c)_________________
27.(12分)在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系.
Cr2O72-+H2O ![]() 2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈___________色,因为__________。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则溶液呈___________色,
因为__________。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡___________,
溶液颜色将__________。
参考答案
一、选择题 (本题包括10小题,每小题2分,每小题只有一个答案符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | C | C | B | C | A | B | A | C | B |
二、选择题(本题包括12小题,每小题3分,共36分。每题有1-2个选项符合题,少选
扣2分,多选、错选均不给分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| AC | D | AC | BD | A | D | CD | A | C | BC |
| 21 | 22 | ||||||||
| BD | AC |
三、填空题
23、⑴2、1、3、2
⑵气、固或液、固、气
⑶放热
24、⑴右;减小;增大
⑵右;OH-;NH3•H2O;NH3
⑶左;NaOH固体溶解,溶液中产生气泡
25、⑴不变 ⑵减小 ⑶减小
26、⑴c = 2 ⑵ b = 0.25;c = 1.5 ⑶ a + c = 2,2b + c = 2
27、⑴黄;中和H+平衡向正反应方向移动
⑵橙红色;增加生成物浓度平衡向逆反应方向移动
⑶正反应移动;变浅