2003-2004学年度上学期
高中学生学科素质训练
高二化学同步测试(8)—水的电离和溶液的pH值
一、选择题 (本题包括10小题,每小题2分,每小题只有一个答案符合题意)
1.下列液体pH>7的是 ( )
A.人体血液 B.蔗糖溶液 C.橙汁 D.胃液
2.常温下,在0.1 mol·L-1 CH3COOH溶液中,水的离子积是 ( )
A.1×10-14 B.1×10-13. C.1.32×10-14 D.1.32×10-15.
3.90℃时水的离子积KW=3.8×10-13,该温度时纯水的pH ( )
A.等于7 B.介于6~7之间. C.大于7 D.无法确定
4.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是 ( )
A.向水中投入一小块金属钠 . B.将水加热煮沸.
C.向水中通入二氧化碳气体. D.向水中加食盐晶体
5.下列酸溶液的pH相同时,其物质的量浓度最小的是 ( )
A.H2SO3 B.H2SO4. C.CH3COOH D.HNO3.
6.常温下c(OH-)最小的是 ( )
A.pH=0的溶液. B.0.05 mol·L-1 H2SO4.
C.0.5 mol·L-1 HCl. D.0.05 mol·L-1的Ba(OH)2
7.用蒸馏水稀释1 mol·L-1醋酸时,始终保持增大趋势的是 ( )
A.溶液中的c(CH3COO-) B.溶液中的c(H+).
C.溶液中的c(CH3COOH). D.溶液中的c(OH-)
8、25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是 ( ).
A.1×10-7mol·L-1 B.1×10-12mol·L-1.
C.1×10-2mol·L-1 D.1×10-14mol·L-1.
9、pH和体积都相同的醋酸和硫酸,分别与足量的Na2CO3溶液反应,在相同条件下
放出二氧化碳气体的体积是 ( )
A.一样多 B.醋酸比硫酸多.
C.硫酸比醋酸多 D.无法比较
10.95℃时,水中的H+的物质的量浓度为10-6 mol·L-1,若把0.01 mol的NaOH固体溶
解于95℃水中配成1 L溶液,则溶液的pH为 ( )
A.4 B.10 C.2 D.12
二、选择题(本题包括15小题,每小题3分,共45分。每题有1-2个选项符合题,少选
扣2分,多选、错选均不给分)
11.将pH=6的CH3COOH溶液加水稀释1000倍后,溶液中的 ( )
A.pH=9 B.c(OH-)≈10-5mol·L-1.
C.pH≈7 D.c(OH-)≈10-7 mol·L-1.
12.体积相同,pH也相同的HCl、HNO3、CH3COOH分别与足量的NaHCO3反应,产
生CO2的体积 ( )
A.同样多 B.HCl最多.
C.HCl、HNO3一样多 D.CH3COOH最多.
13.把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则两种溶液的
体积比应是 ( )
A.10∶1 B.1∶10 C.1∶100 D.1∶2.
14.下列溶液一定是碱性的是 ( )
A.溶液中c(OH-)>c(H+). B.滴加甲基橙后溶液显红色.
C.溶液中含有OH-. D.滴加甲基橙后溶液显黄色.
15.常温时,下列溶液的pH等于8或大于8的是 ( )
A.0.1 mol·L-1的NaOH溶液滴定稀盐酸,用酚酞做指示剂滴定到终点
B.pH=6的醋酸用水稀释100倍
C.pH=10的氢氧化钠溶液稀释1000倍
D.0.1 mol·L-1的硫酸100 mL跟0.2 mol·L-1 NaOH溶液150 mL完全反应
16.下列说法中正确的是 ( )
A.100 mL pH=3的盐酸和醋酸溶液,与足量锌反应时,起始时二者产生氢气的速率基
本相等.
B.100 mL 1 mol·L-1的盐酸和50 mL 2 mol·L-1的盐酸分别与足量的锌反应,两者放出氢气的速率和质量均相等.
C.100 mL pH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量相等.
D.100 mL 0.1 mol·L-1的硫酸和盐酸溶液,与足量锌反应后,前者放出氢气的质量
是后者放出氢气质量的2倍.
17.某酸溶液的pH=1,此酸溶液的物质的量浓度 ( )
A.0.1 mol·L-1.
B.一定大于0.1 mol·L-1.
C.若为强酸一定等于0.1 mol·L-1,若为弱酸一定大于0.1 mol·L-1.
D.若为强酸一定≤0.1 mol·L-1,若为弱酸一定>0.1 mol·L-1.
18.某温度下,重水D2O的离子积为1.6×10-15,若用pH一样的定义来规定
pD=-lgc(D+),以下关于pD的叙述正确的是 ( )
A.中性溶液的pD=7.0.
B.含0.01 mol的NaOD的D2O溶液1L,其pD=12.0.
C.溶解0.01 mol的DCl的D2O溶液1L,其pD=2.0.
D.在100 mL 0.25 mol·L-1的DCl重水溶液中,加入50 mL 0.2mol·L-1的NaOD的
重水溶液,其pD=1.0.
19.有人曾建议用AG表示溶液的酸度(acidity arede),AG的定义为 ( )
AG=lg([H+]/[OH-])。下列表述正确的是
A.在25℃时,若溶液呈中性,则pH=7,AG=1
B.在25℃时,若溶液呈酸性,则pH<7,AG<0
C.在25℃时,岩溶液呈碱性,则pH>7,AG>0
D.在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH)
20.pH=9 的Ba(OH)2溶液与pH=12的KOH溶液,按4︰1的体积比混合,则混合溶
液中H+浓度为(单位:mol·L-1) ( )
A.![]() ×(4×10-9+1×10-12)
B.
×(4×10-9+1×10-12)
B.![]() ×(8×10-9+1×10-12)
×(8×10-9+1×10-12)
C.5×10-10 D.5×10-12
21.pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的
体积比是 ( ).
A.11∶1 B.9∶1 C.1∶11 D.1∶9.
22.某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶
液体积V(酸)和碱溶液体积V(碱)的正确关系为 ( )
A.V(酸)=102V(碱) B.V(碱)=102V(酸).
C.V(酸)=2V(碱) D.V(碱)=2V(酸)
23.在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.01mol/L的醋酸溶液相比较,
下列数值前者大于后者的是 ( )
A.中和时所需NaOH的量 B.电离度
C.对的物质的量 D.CH3COOH的物质的量
24.将pH= l的盐酸平均分成 2份,l份加适量水,另1份加入与该盐酸物质的量浓度
相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为( )
A. 9 B.10 C.11 D.12
25.水的电离过程为H2O![]() H++OH-,在不同温度下其平衡常数为
H++OH-,在不同温度下其平衡常数为
K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是
A.C(H+)随着温度升高而降低
B.在35℃时,C(H+)>C(OH-)
C.水的电离度(25℃)>(35℃)
D.水的电离是吸热的
三、填空题
26.(4分)在95℃时,纯水的pH (填“大于”“小于”“等于”)7,所选择的
理由是 。
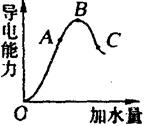 27.(6分)在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如右图所示。请回答:
27.(6分)在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如右图所示。请回答:
(1)“O”点导电能力为“0”的理由是
_______________________。
(2)A、B、C三点pH值由大到小的顺序是
_______________________。
(3)A、B、C三点电离度最大的是____________________。
28.(8分)在25℃时,有pH为a的HCl溶液和pH为b的NaOH
溶液,取VaL该盐酸溶液用该NaOH溶液中和,需VbL NaOH
溶液,问:
(1)若a+b=14,则Va/Vb= .
(2)若a+b=13,则Va/Vb=
(3)若a+b>14,则Va/Vb= ,且Va Vb(填“>”“<”“=”)
(题中a≤b,b≥8)。.
29.有一pH = 12的NaOH溶液100 mL ,欲使它的pH降为11。
(1)如果加入蒸馏水,就加入________ mL
(2)如果加入pH = 10的NaOH溶液,应加入_________ mL
(3)如果加入0.008 mol/L HCl溶液,应加入__________ mL
30.用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.1mol/L的溶液100mL;
②用PH试纸测出该溶液的PH值,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制PH=1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是_____________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的PH_________1(选填>、<、=);乙方案中,说明HA是弱电解质的现象是_____________(多选扣分)
(a)装HCl的试管中放出H2的速率快
(b)装HA溶液的试管的中放出H2的速率快
(c)两个试管中产生气体速率一样快
(3)请你评价:乙方案中难以实现之处和不妥之处________________________。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
四、计算题
31.把一小块金属钠投入100 mL 0.15 mol/LCuCl2溶液中,收集到产生的气体的体积为
1.456L(标准状况下),此时溶液体积仍然为100 mL 。计算
(1)加入金属钠的质量
(2)反应后溶液的pH
参考答案
一、选择题 (本题包括10小题,每小题2分,每小题只有一个答案符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | A | B | C | B | B | D | B | B | B |
二、选择题(本题包括15小题,每小题3分,共45分。每题有1-2个选项符合题,少选
扣2分,多选、错选均不给分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| CD | CD | B | A | AD | AD | D | CD | D | D |
| 21 | 22 | 23 | 24 | 25 | |||||
| D | B | BC | C | D |
三、填空题
26、小于;250C时纯水的pH = 7,当升高温度时,水的电离程度增大,c(H+)也增大,故
pH减小
27、⑴冰醋酸只有在水溶液中电离,“O”点时为纯醋酸,难电离,可视为不导电。
(2)C>A>B (3)C
28、⑴1 ⑵ ![]() ⑶10a + b – 14;>
⑶10a + b – 14;>
29、⑴ 900 ⑵ 1000 ⑶ 100
30、(1)100mL溶量瓶(注:未标明规格的扣1分) (2)>b(多选扣分)
(3)配制pH=1的HA溶液难以实现,不妥之处在于加入的锌粒表面积难以做到相同
(4)配制NaA溶液,测其pH值>7即证明HA是弱电解质。
31、⑴ 2.99 g ⑵ 14