第四节 第二课时
1、下列叙述仪器“0”刻度位置正确的是 ( )
A.在量筒的上端 B.在滴定管的上端
C.在托盘天平刻度尺的正中 D.在托盘天平刻度尺的右边
2、下列实验方法能够达到要求的是 ( )
A.用250mL的容量瓶配制200mL的Na2CO3溶液
B.用托盘天平称量25.20g NaCl
C.用25mL滴定管量取14.80mL溶液
D.用广泛pH试纸测得某碱液的pH为12.5
3、在滴定有甲基橙试剂的50mL0.05mol/L的一元强酸溶液中,滴入0.1mol/L的烧碱溶液,当滴至橙色刚好变为黄色时所用烧碱溶液的体积为( )
A.大于25mL B.等于25mL C.小于25mL D.无法确定
4、两人用同一瓶标准盐酸滴定同一瓶NaOH溶液,甲将锥形瓶用NaOH待测液润洗后,使用水洗过的碱式滴定管取碱液于锥形瓶中.乙则用甲用过的碱式滴定管取碱液于刚用水洗过且存有蒸馏水的锥形瓶中,其它操作及读数全部正确,下列说法正确的是 ( )
A.甲操作有错 B.乙操作有错
C.甲测定数值一定比乙小 D.乙实际测得值较准确
5、现用pH=3的CH3COOH溶液和pH=11的NaOH溶液各VmL,进行中和滴定,当滴定到pH=7时,锥形瓶内溶液的体积为(滴定前后溶液未稀释、总体积不变) ( )
A.2V B.小于2V C.大于2V D.小于、等于或大于2V
6、用NaOH溶液滴定盐酸时,由于滴定速度太快,当混合溶液变红时不知NaOH是否过量,判断它是否过量的方法是 ( )
A.加入5mL盐酸再进行滴定 B.返滴一滴待测盐酸
C.重新进行滴定 D.以上方法均不适用
7、在一支25ml的碱式滴定管中,盛装溶液时液面恰好在10.00ml处.若将管内液体全部放出,用量筒接取,所得溶液的体积为 ( )
A.10.00ml B.15.00ml C.大于15.00ml D.小于15.00ml
8、下列有关中和滴定实验的操作顺序:①用标准溶液润洗滴定管 ②往滴定管中注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,其中正确的是 ( )
A.③⑤①②④ B.⑤①②③④ C.③⑤②①④ D.③①②④⑤
9、已知常温、常压下,饱和CO2水溶液的PH为3.9,可推断用标准盐酸滴定NaHCO3水溶液时,适宜选用的指示剂及滴定至终点时颜色变化的情况是A.石蕊,由蓝变红 B.甲基橙,由黄变橙 ( )
C.酚酞,红色褪去 D.甲基橙,由橙色变黄色用已知浓度的
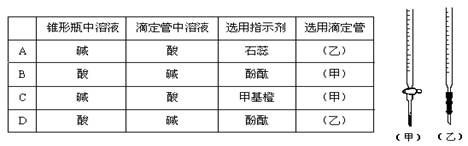
10、NaOH溶液测定某H2SO4溶液的浓度,参考右图,从下表中选出正确选项 ( )
 11、(1)图I表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,如果刻度A为4,则量筒中液体的体积是 mL。
11、(1)图I表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,如果刻度A为4,则量筒中液体的体积是 mL。
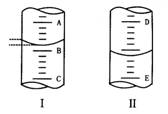 (2)图Ⅱ表示50mL滴定管中液面的位置,如果液面处的读数为a,则滴定管中液体的体积为 ( )
(2)图Ⅱ表示50mL滴定管中液面的位置,如果液面处的读数为a,则滴定管中液体的体积为 ( )
A、是a mL B、是(50-a)mL
C、一定大于a mL D、一定大于(50-a)mL
12、实验室需配制1mol/L的NaOH溶液和1mol/L的H2SO4溶液各100mL。
(1)要配制NaOH溶液,应用托盘天平称取NaOH固体
A.4g B.4.00g C.4.0g D.4.000g
(2)在配制NaOH溶液和H2SO4溶液的各步操作中,有明显不同的是
A.称量或量取 B.溶解 C.、移液、洗涤 D.定容
(3)两溶液各取10.0mL混合,在混合液中滴加甲基橙,溶液颜色为 A.红色 B.橙色 C.黄色 D.蓝色
(4)若用1mol/L H2SO4滴定上述NaOH溶液10 mL时,在滴定过程中有误差产生,如①多滴了1滴H2SO4(1滴溶液体积约为0.05mL),②少滴了1滴H2SO4溶液,反应后两溶液中c(H+)之比为 。
13、取相同体积(25ml)的两份0.01mol/LNaOH溶液,把其中一份放在空气中一段时间后,溶液的pH (填增大,减小或不变),其原因是 ,用已知浓度的硫酸溶液中和上述两份溶液,若中和第一份(在空气中放置一段时间的那份)所消耗硫酸的体积为V(A),另一份消耗硫酸溶液的体积为V(B),则
(1)以甲基橙为指示剂时,V(A)与V(B)的关系是
(2)以酚酞为指示剂时,V(A)与V(B)的关系是