08年高三化学第一学期第四次月考
化 学 试 卷
范围:中学化学 命题人:高三化学备课组 时间:2007-12-2
可能用到的相对原子质量:C:12 O:16 H:1 Fe:56 Na:23 S:32 Cl:35.5 Si:28 Mg:24 K:39 Ba:137 Ag:108
第Ⅰ卷 选择题(共48分)
选择题(每小题3分,本题共48分。每小题只有一个选项符合题意)
1.1995年我国科学家发现了91号元素中的一种新原子,其质量数为239,则该新原子的中子数是 ( )
A.330 B.239 C.148 D.91
2.下列叙述正确的是( )
A.离子晶体中只存在离子键
B.原子晶体中只存在非极性共价键
C.冰是水分子间通过氢键作用有规则排列成的分子晶体
D.液态氯化钠和铜导线的导电原理是相同的
3.已知常温常压下,N2(气)和H2(气)反应生成2molNH3(气)放出92.4kJ热量。在同温同压下向密闭容器中通入1molN2和3molH2,达到平衡时放出热量为Q1kJ;向另一体积相同的密闭容器中通人0.5molN2、1.5molH2和1molNH3,相同条件下达到平衡时放出热量为Q2kI。则下列关系式正确的是 ( )
A.2Q2=Q1=92.4 B.Q2<Q1<92.4
C.Ql<Q2<92.4 D.Ql=Q2<92.4
4.氯仿(CHCl3)可用作麻醉剂,常因保存不慎被空气氧化而产生剧毒物COCl2(光气)和氯化氢,为了防止事故发生,在使用前要检查氯仿是否变质,应选用的检查试剂是( )
A.NaOH溶液 B.AgNO3溶液
C.BaCl2溶液 D.KI溶液
5.最近医学界通过用具有放射性的14C试验,发现C80的一种羧酸衍生物在特定条件下可通过断裂DNA杀死病毒,从而抑制艾滋病(AIDS)的传播。有关14C试验的叙述中正确的是( )
A.与C80中普通碳原子的化学性质不同 B.与12C互为同位素
C.与12C中的中子数相同 D.与C80互为同素异形体
6.X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.X的气态氢化物比Y的气态氢化物稳定
C.X的氢化物的沸点比Y的氢化物的沸点低
D.Y的单质能和NaX的溶液反应生成X的单质
7.下列说法正确的是( )
A.氮族元素的单质的沸点随由上至下的顺序递增。
B.氮单质的熔沸点低于白磷,说明氮单质的稳定性弱,氮元素的非金属性强。
C.氮族元素的氢化物中,NH3最稳定,说明氮的非金属性最强。
D.白磷比红磷活泼的原因是它们各由不同种的磷原子构成。
8.下列实验操作正确的是( )
A.将氢氧化钠固体放在滤纸上称量
B.用10mL量筒量取8.58mL蒸馏水
C.制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集
D.配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
9.下列关于浓硫酸的叙述正确的是 ( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
10.用NA表示阿伏加德罗常数,下列说法正确的是( )
A.每升硫酸溶液里含有10-2NA个H+,该硫酸溶液的pH为2
B.呈中性的稀溶液1L里含有10-7NA个H+
C.NA个NH4+有10mol质子
D. 标况下VL水中含有的氧原子个数为VNA/22.4
11.已知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是( )
A.![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]()
12.下列离子方程式正确的是( )
A.等物质的量的硫酸氢钠溶液跟氢氧化钡溶液混合:
H++SO42- +Ba2+ +OH- == BaSO4↓ + H2O
B.标准状况下将112mL氯气通入10mL1moL·L-1的溴化亚铁溶液中:
![]()
C.用NaOH吸收少量![]()
D.向碳酸氢镁溶液中加入过量的澄清石灰水:
![]()
13.鉴别下列物质只能采用焰色反应的是( )
A.![]() B.
B.
![]()
C. ![]() D.
D.
![]()
14.下列溶液中,微粒浓度关系正确的是( )
A.含有![]() 、
、![]() 、
、![]() 、
、![]() 离子的溶液,其离子浓度一定是:
离子的溶液,其离子浓度一定是:
![]()
B.pH=8的氨水与氯化铵的混合溶液中:![]()
C.0.1mol·L-1的Na2S溶液中:![]()
D.pH=3的一元酸和pH=11的一元强碱等体积混合:![]()
![]() 15.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
15.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向逆反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.a>b
16.气体X可能含有NH3、Cl2、HBr、CO2中的一种或几种。已知X通入AgNO3溶液时产生淡黄色沉淀,该沉淀不溶于稀硝酸,若将X通入澄清石灰水中,不见沉淀生成,有关气体X的成分说明正确的是( )
A.一定含有NH3 B.一定含有CO2
C.可能含有Cl2 D.一定含有HBr,一定不含NH3,可能含有CO2
第Ⅱ卷 非选择题(共52分)
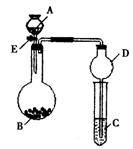 17.(9分)某同学设计了右图所示装置(未画夹持仪器)进行系列实验。实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
17.(9分)某同学设计了右图所示装置(未画夹持仪器)进行系列实验。实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
(1)若A为浓氨水,B为烧碱,C中盛有AlCl3溶液,旋开活塞E,足够长时间后,观察到C中的现象为: ,C中发生反应的离子方程式为: 。
(2)若A为30%的H2O2溶液,B为二氧化锰,C中盛有氢硫酸饱和溶液,旋开活塞E后,观察到C中的现象为 ,C中发生反应的化学方程式为 ;
(3)利用上述装置还可以验证物质的性质,如设计证明氧化性;KMnO4>Cl2>Br2,则A中加浓盐酸,B中加 ,C中加 ,观察到C中的现象是 。
18.(7分)A、B、C、D均为中学化学的常见物质,它们间的反应关系如图所示:
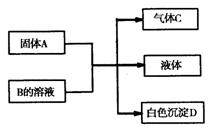
(1)若A是短周期主族元素中原子半径最大的元素构成的单质,D既可溶于盐酸又可溶于NaOH溶液。图示转化中的离子方程式为 。
(2)若C是元素M的气态氢化物,且C能与M的最高价氧化物的水化物反应生成盐E;B是一种正盐,与E含有相同的阳离子;D不溶于稀硝酸。
A的化学式为 。
C的电子式为 ,C的空间构型是 。
B的溶液中各离子浓度由大到小的顺序为 。
19.(10分)为了测定氢氧化钠和碳酸钠固体混合物中碳酸钠的质量分数,甲、乙两位同学分别设计了如下的实验方案:
(I)甲同学的方案是:将mg样品溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称得固体ng。
(1)混合物中碳酸钠的质量分数为(用m、n表示) ,甲同学洗涤沉淀的具体操作是 。
(2)Ca2+、Ba2+都可以使CO32-沉淀完全,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因是:① ;② 。
(Ⅱ)乙同学的方案如图所示:
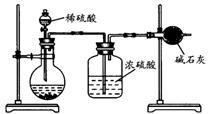 |
(3)根据乙同学的实验装置图分析,在每次实验中,完成测定过程至少要进行
次称量操作。按照该同学的方案进行测定,结果与实际情况存在较大的误差,你认为主要原因可能是(任写两个): ① ;② 。
(4)乙同学的方案的装置中存在一定的缺陷,请你提出改进的方法(简单叙述做法,不必画图): 、 。
![]()
![]() 20.(10分)中国是《日内瓦协定书》的缔约国,一贯反对使用化学武器,反对任何形式的化学武器扩散,苯氯乙酮是一种具有荷花香味且有强催泪作用的化学毒剂,它的结构式为:
20.(10分)中国是《日内瓦协定书》的缔约国,一贯反对使用化学武器,反对任何形式的化学武器扩散,苯氯乙酮是一种具有荷花香味且有强催泪作用的化学毒剂,它的结构式为:
已知:a.甲醛分子中所有原子均在同一个平面内。
(1)苯氯乙酮分子中,在同一个平面内的碳原子最多有 个。
(2)苯氯乙酮不可能发生的化学反应是 。
A.加成反应 B.取代反应 C.消去反应 D.水解反应 E.银镜反应
(3)分子有苯环但不含甲基,且能发生银镜反应的苯氯乙酮的同分异构体有
种。
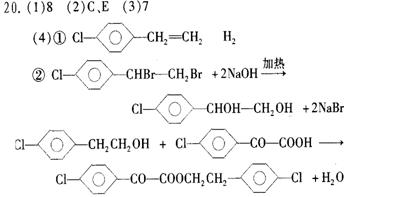
(4)苯氯乙酮的一种同分异构体有以下的转化关系:
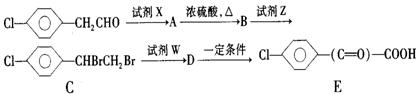 |
请写出①B的结构简式 ,试剂x为
②下列转化的化学方程式:
C→D: ; A+E→F:
21.(10分)(1)已知下列反应在一定的条件下可以发生:H2O2 +2Fe2+ +2 H+ ==2Fe3+ +2H2O H2O2 +2Fe3+== 2Fe2+ + O2↑+ 2H+
在以上反应中Fe2+实际上起着_________作用,总反应式为_______________
(2)I2也是Fe2+一样发生上述类似反应,类比(1)在下面填入配平的合适的化学反应方程式:H2O2 + I2==2HIO, ______________________________,
总反应式为____________________________。
(3)在H2SO4 和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色。并可以使淀粉变蓝。有学生认为该反应的离子方程式为:
H2O2 +2 I—== I2+ O2↑+ 2H+ ,这个方程式正确吗?____________。若正确,理由是(若认为不正确,该步不必作答)_______________________,若不正确,原因是(若认为正确,该步不做答)__________________。并写出正确的化学方程式为(若是离子反应,写出离子反应方程式,没有离子反应的,写出化学方程式):_______________________ 、________________________。
(4)若将H2O2 滴入酸性高锰酸钾溶液中,产生无色气体,同时溶液的紫色变浅,无沉淀生成,写出反应的离子方程式______________________________。
22.(6分)3.2g Cu与50ml浓H2SO4(足量)在加热条件下充分反应。
(1)被还原的H2SO4的物质的量为 。
(2)若50ml浓H2SO4中含溶质为amol,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4) 0.5amol(填“>”、“<”或“=”)。
(3)把题干中反应后的溶液稀释至500ml,取出50ml,并向取出液中加入足量的BaCl2溶液,得沉淀20.27g,求原浓H2SO4的物质的量浓度
化 学 试 卷 答 题 卡
答 题 卡
 | ||
 | ||
| 17.(9分) (1) , 。 (2) , 。 (3) , , 。 18.(7分) (1) (2) , 。 , 。 19.(10分) (1) , 。 (2)① ② 。 (3) , , 。 (4) 、 。 20.(10分) (1) ;(2) ;(3) ; (4)① , 。 ② , 。 21.(10分) (1) , (2) , (3) , , (4) 。 22. (6分) (1) ;; (2) ; (3) 。 |
第四次月考化学试题参考答案
一、选择题(3分×16=48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | C | B | B | B | B | C | D |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | A | D | A | D | C | C | D |
二、填空题
17、(1)有白色沉淀产生。Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(2)有淡黄色沉淀产生,2H2S+O2=2H2O+2S↓
(3)KMnO4,NaBr,溶液呈橙色
18、(1)6Na+2Al3++6H2O=6Na++Al(OH)3↓+3H2↑
![]() (2)
(2)![]() ,
,![]() ,三角锥型
,三角锥型
![]()

![]() 21.
21.![]() (1)催化剂 2H2O2 2H2O+O2↑
(1)催化剂 2H2O2 2H2O+O2↑
(2)H2O2 + 2HIO ==I2+O2↑+2H2O 2H2O2 2H2O+O2↑
![]() (3)不正确 反应中只有化合价升高而没有化合价降低 2H++2I-+H2O2
==I2+2H2O,
(3)不正确 反应中只有化合价升高而没有化合价降低 2H++2I-+H2O2
==I2+2H2O,
2H2O2 2H2O+O2↑
(4)5H2O2+ 2MnO4-+ 6H+=2Mn2++5O2↑+8H2O
22.(1)0.05mol(数值单位各1分)
(2)< (2分)
(3)![]()
![]()
![]()
| 第四次月考考试成绩 | |||||
| 班级 | 高三(5)班 53人 | 高三(6)班 36人 | 高三(7)班 41人 | 高三(8)班 38人 | 全年级理科 168人 |
| 人平分 | 51.34 | 67.86 | 78.54 | 75.08 | 66.89 |
| 优秀人数 | 1 | 5 | 21 | 16 | 43 |
| 及格人数 | 15 | 27 | 38 | 35 | 115 |