高三第一次月考化学试题
范围:中学化学 命题人:高三化学备课组 时间: 2008-9-7
第Ⅰ卷(选择题,共40分)
可能用到的原子量:H:1 O:16 C:12 N:14 Si:28 P:31 S:32 Cl:35.5
Na:23 Mg:24 Al:27 Fe:56 Cu:64 Zn:65 Ca:40 Ba:137A
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
1、许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是
A、氯、溴、碘 B、钠、镁、铝
C、烧碱、氢气 D、食盐、淡水
2.下列叙述正确的是
A、 日常生活中无水乙醇常用于杀菌消毒
B 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
C、目前加碘食盐中主要添加的是KIO3
D、在PH=1的含有Mg2+、Fe2+、Al3+三种阳离子的溶液中,可能存在阴离子Cl— 、NO3— 、SO42—
3、下列说法正确的是
A、硅材料广泛用于光纤通讯
B、工艺师利用盐酸刻蚀石英制作艺术品
C、水晶项链和餐桌上的瓷盘都是硅酸盐制品
D、粗硅制备单晶硅不涉及氧化还原反应
4、氯气是一种重要的工业原料。工业上利用反应在3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
A、若管道漏气遇氨就会产生白烟
B、该反应利用了Cl2的强氧化性
C、该反应属于复分解反应
D、生成1molN2有6mol电子转移
5. 物质的量浓度相同时,下列既能与NaOH溶液反应、又能跟盐酸反应的溶液中,pH最大的是
A Na2CO3溶液 B NH4HCO3溶液 C NaHCO3溶液 D NaHSO4溶液
6. ![]() U是重要的核工业原料,在自然界的丰度很低。
U是重要的核工业原料,在自然界的丰度很低。![]() U的浓缩一直为国际社会关注。下列有关
U的浓缩一直为国际社会关注。下列有关![]() U说法正确的是
U说法正确的是
A ![]() U原子核中含有92个中子 B
U原子核中含有92个中子 B ![]() U原子核外有143个电子
U原子核外有143个电子
C ![]() U与
U与![]() U互为同位素 D
U互为同位素 D ![]() U与
U与![]() U互为同素异形体
U互为同素异形体
7、科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
A、H2 + 2OH- =2H2O+2e- B、O2 + 4H+ + 4e- = 2H2O
C、H2 = 2H+ + 2e- D、O2 + 2H2O + 4e- = 4OH-
8、下列符合化学实验“绿色化”的有
① 在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水
② 在铜和浓硝酸反应的实验中,将铜片改为可调节高度的铜丝
③ 将实验室的废酸液和废碱液中和后再排放
A、①② B、①③ C、②③ D、①②③
9. 下列实验操作完全正确的是
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
10.茉莉醛具有浓郁的茉莉花香,其结构简式如下所示:

CH=C-CHO
关于茉莉醛的下列叙述错误的是
A.在加热和催化剂作用下,能被氢气还原
B.能被高锰酸钾酸性溶液氧化
C.在一定条件下能与溴发生取代反应
D.不能与氢溴酸发生加成反应
11、某溶液中含有HCO3- 、 CO32- 、 SO32- 、 Na+ 、 NO3-五种离子。若向其中加入Na2O2粉未,充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是
A、CO32- 、NO3- B、NO3-
C、SO32- 、NO3- D、CO32- 、NO3-、 Na+
12、下列说法正确的是
A、硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B、蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C、绿色食品是不含任何化学物质的食品
D、在空气质量日报中CO2含量高于空气污染指数
13.若NA表示阿佛加德罗常数,下列说法正确的是
A、常温常压下,4.6gNO2和N2O4混合气体气体中含有6.02×1022个N原子
B、0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
C.15克CH3+中含有NA个电子
D.NA个一氧化碳分子和22.4L甲烷的质量比为7 :4
14、下列化学反应的离子方程式正确的是
A、用小苏打治疗胃酸过多: HCO3- + H+ == CO2↑+ H2O
B、往碳酸镁中滴加稀盐酸: CO32- + 2H+ == CO2↑+ H2O
C、往氨水中滴加氯化铝: Al3+ + 4OH- == AlO2- + 2H2O
D、碳酸氢钠溶液与足量氢氧化钡溶液混合:2HCO3-+Ba2++2OH-==BaCO3↓+2H2O+CO32-
15、灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
① Sn(s、白) + 2HCl(aq)= SnCl2(aq)+ H2(g) △H1
② Sn(s、灰) + 2HCl(aq)= SnCl2(aq)+ H2(g) △H2
![]()
![]()
![]()
![]()
|
下列说法正确的是
A、△H1 >△H2
B、锡在常温下以灰锡状态存在
C、灰锡转化为白锡的反应是放热反应
D、锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
16.往含I-和Cl-的稀溶液中滴入AgNO3溶液,
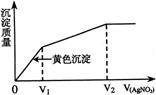 沉淀的质量与加入AgNO3溶液体积的关系如
沉淀的质量与加入AgNO3溶液体积的关系如
右图所示。则原溶液中c(I-)/c(Cl-)的比值为
A (V2-V1)/V1 B V1/V2
C V1/(V2-V1) D V2/V1
17. a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4 的物质的量之比为
A.1 :7 B.7 :1 C.7 :8 D.8 :7
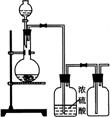 18.可用右图装置制取(必要时可加热)、净化、收集的
18.可用右图装置制取(必要时可加热)、净化、收集的
气体是
A 铜和稀硝酸制一氧化氮
B 氯化钠与浓硫酸制氯化氢
C 锌和稀硫酸制氢气
D 硫化亚铁与稀硫酸制硫化氢
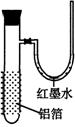 19.用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如下图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是
19.用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如下图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是
A 实验中发生的反应都是氧化还原反应
B 铝是一种较活泼的金属,
C 铝与氧气反应放出大量的热量
D 铝片上生成的白毛是氧化铝和氧化汞的混合物
20.一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
提示:①H2C2O4是二元弱酸;
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
A 0.008889 B 0.08000 C 0.200 D 0.240
第Ⅱ卷(非选择题,共60分)
二. 填空题(50分)
21.(6分)下列实验操作能达到实验目的的是__________________(填代号)。
A.向沸水中滴入少量浓FeCl3溶液,煮沸至呈红褐色,制取Fe(OH)3胶体
B.向盛有稀HNO3的试管中加入铜片,稍稍加热,观察生成的NO气体
C.将pH试纸湿润后用于鉴别NH3和HCl两种刺激性气体
D.用滴管吸取NaOH溶液滴入久置的FeSO4溶液中,制取Fe(OH)2
E.将充有NO2气体的密闭玻璃球放入热水中,验证温度对化学平衡的影响
22. (18分)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
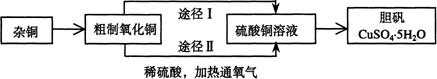 |
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:a 蒸发皿 b 石棉网 c 泥三角
d 表面皿 e 坩埚钳 f 试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是
a 灼烧过程中部分氧化铜被还原 b 灼烧不充分铜未被完全氧化
c 氧化铜在加热过程中分解生成铜 d 该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是: 、
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次
(6)若测定结果x值偏高,可能的原因是
a 加热温度过高 b 胆矾晶体的颗粒较大
c 加热后放在空气中冷却 d 胆矾晶体部分风化
23. (8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原
因是: 。
24. (18分)物质的转化关系如下图所示,其中甲可由两种单质直接化合得到,乙为金属单质,F的溶液中只含一种溶质,G为酸,乙在G的浓溶液中发生钝化。有的反应可能在水溶液中进行,有的反应中生成物未全部给出,反应条件也未注明。
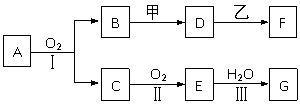
⑴若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
①1.7 g A与O2反应生成气态的B和C时放出22.67 kJ热量,写出该反应的热化学方程式__________________________________________。
②B与甲反应的离子方程式是__________________________________ 。
③D的水溶液和F的水溶液中由水电离出的c(OH-)___________(填字母序号)。
(a)前者大 (b)后者大
(c)一样大 (d)不知浓度,无法比较
⑵若B为红棕色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应Ⅰ在_______________中进行,反应Ⅲ在_______________(均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是_________或________。
③D和乙反应的离子方程式是______________________________。
三. 计算题(10分)
25.一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
 |
高三第一次月考化学答题卡
请将选择题答案填入下表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
21.(6分)____________________
22.(18分)
(1)______________ _____________ _______________
(2)___________
(3)__________________ _________________
(4)_______________________________ _______________________
(5)_______________
(6)___________________
23(8分)
(1)__________________________________________________
(2)__________________ ___________________
(3)_____________________
(4)__________________________________________________
24(18分)
(1)①____________________________________________
②______________________________________________________
③_____________________
(2)①_______________________ _____________________
②_____________________ ________________________
③____________________________________________________
25.(10分)
(1)_________________________
(2)_____________________________
(3)_______________________________
高三第一次月考化学试题参考答案
1-10:D/C/A/C/C/C/C/D/C/D
11-20:B/B/A/A/D/C/B/B/D/B
21:ACE
22.(1)c e
b
(2)a b
(3)蒸发 过滤
(4)产生等量胆矾途径Ⅱ消耗硫酸少 途径Ⅱ不会产生污染大气 的气体
(5)4
(6)a
23.(1)14HNO3+3Cu2O→6Cu(NO3)2+2NO↑+7H2O
(2)酸性 氧化性
(3)0.6mol
(4)使用了较浓的硝酸,产物中有部分二氧化氮生成
24.⑴①4NH3(g)+5O2(g)=4NO(g)+6H2O(g);ΔH=-906.8 kJ·mol-1
②2Na2O2+2H2O=4Na++4OH-+O2↑ ③(b)
⑵①沸腾炉 吸收塔 ②点燃 光照
③Fe+2Fe3+=3Fe2+
25.(1)10.7% (2)0.25 (3)3︰2
高三第一次月考化学试题参考答案
1-10:D/C/A/C/C/C/C/D/C/D
11-20:B/B/A/A/D/C/B/B/D/B
21:ACE
22.(1)c e
b
(2)a b
(3)蒸发 过滤
(4)产生等量胆矾途径Ⅱ消耗硫酸少 途径Ⅱ不会产生污染大气 的气体
(5)4
(6)a
23.(1)14HNO3+3Cu2O→6Cu(NO3)2+2NO↑+7H2O
(2)酸性 氧化性
(3)0.6mol
(4)使用了较浓的硝酸,产物中有部分二氧化氮生成
24.⑴①4NH3(g)+5O2(g)=4NO(g)+6H2O(g);ΔH=-906.8 kJ·mol-1
②2Na2O2+2H2O=4Na++4OH-+O2↑ ③(b)
⑵①沸腾炉 吸收塔 ②点燃 光照
③Fe+2Fe3+=3Fe2+
25.(1)10.7% (2)0.25 (3)3︰2