08年高三化学第一学期第三次月考
化 学 试 卷
范围:中学化学 命题人:高三化学备课组 时间:2007-11-5
可能用到的相对原子质量:C:12 O:16 H:1 Fe:56 Na:23 S:32 Cl:35.5 Si:28 Mg:24 K:39 Ba:137 Ag:108
第Ⅰ卷 选择题(共48分)
选择题(每小题3分,本题共48分。每小题只有一个选项符合题意)
1.正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是( )
A.物质熔沸点的高低顺序是:氯化钠>晶体硅>冰>氖气
B.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
C.P4、CH4、NH4+粒子的空间构型均为正四面体型;CO2、C2H2均为直线型分子
D.Ca2+的结构示意图为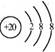 ,NH4Cl的电子式为
,NH4Cl的电子式为![]()
2.下列说法或表示方法正确的是 ( )
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.中和热一定是强酸跟强碱反应放出的热量
C.由石墨比金刚石稳定可知: C(金刚石)== C(石墨);ΔH<0
D.在101 kPa、25℃时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式可表示为:
2H2(g) + O2(g) == 2H2O(l);ΔH=-285.8 kJ/ mol
3.下列对物质用途的描述中,错误的是 ( )
A.Na2O2既可作呼吸面具中O 2的来源又可漂白织物、麦杆、羽毛等
B.碳酸钠在医疗上是治疗胃酸过多的一种药剂
C.Na、K合金可作原子反应堆的导热剂
D.钠的还原性很强,可以用来冶炼金属钛、锆、铌等
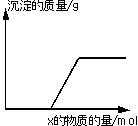
4.将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如下图所示,符合图中这一情况的一组物质是 ( )
| X |
| |
| A | Ba(HCO3)2溶液 | NaOH溶液 |
| B | CO2气体 | 石灰水 |
| C | KOH溶液 | Mg(HSO4)2溶液 |
| D | Na2CO3溶液 | CaCl2溶液 |
5.同温同压下,甲容器中的NH3和乙容器中的CH4所含的原子总数相同,则甲容器与乙容器的体积之比为 ( )
A.1:1 B.2:1 C.4:5 D.5:4
6.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是 ( )
A.2.24LCO2中含有的原子数为0.3 ×6.02×1023
B.58.5g氯化钠中约含有6.02×1023个氯化钠分子
C.0.2 mol过氧化氢完全分解转移的电子数目为0.4×6.02×1023
D.4.5 gSiO2晶体中含有的硅氧键数目为0.3 ×6.02×1023
![]()
![]() 7.未完成的离子方程式为:
+ XO3-+ 6H+ = 3X2 + 3H2O,据此判断:X元素的最高化合价为 (
)
7.未完成的离子方程式为:
+ XO3-+ 6H+ = 3X2 + 3H2O,据此判断:X元素的最高化合价为 (
)
A.+7 B.+5 C.+4 D.+1
8.现有25mL 2mol·L-1的Na2CO3溶液和75mL 1mol·L-1的稀盐酸。
(1)将Na2CO3溶液逐滴滴入稀盐酸中;
(2)将稀盐酸逐滴滴入Na2CO3溶液中。
两操作的现象及结果(标准状况下)为( )
A.现象相同,所得气体的体积相等
B.现象相同,所得气体的体积不等
C.现象不同,所得气体的体积相等
D.现象不同,所得气体的体积不等
9.下列离子方程式书写正确的是 ( )
A.将Ba(OH)2溶液不断加入KAl(SO4)2溶液中反应至沉淀物质的量最大:
3Ba2+ + 6OH– + 2Al3+ + 3SO42–== 3BaSO4↓+ 2Al(OH)3↓
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++OH-+H++SO![]() =BaSO4↓+H2O
=BaSO4↓+H2O
C.CuSO4溶液跟Ba(OH)2溶液混合:Ba2+ + SO42– == BaSO4↓
D.向FeI2溶液中加少量氯水: 2Fe2++Cl2=2Fe3++2Cl-
|
A.含有大量S2-的溶液:ClO-、Na+、Cl-、CO32-
B.能使氢氧化铝迅速溶解的溶液:Na+、Fe2+、NO![]() 、SO
、SO![]()
C.pH=0的溶液:NH4+、Na+、SO42-、Fe3+
D.水电离产生的c(H+)=1×10-12mol/L的溶液:HCO3-、NH4+、Cl-、Ca2+
11.有下列三个反应:①Cl2+FeI2 = FeCl2 + I2 ②2Fe2+ + Br2= 2Fe3++ 2Br-
③Co2O3 + 6HCl = 2CoCl2 + Cl2↑+ 3H2O 下列说法正确的是( )
A.①②③中的氧化产物分别是I2、Fe3+、CoCl2
B.根据以上方程式可以得到氧化性Cl2>Fe3+>Co2O3
C.可以推理得到Cl2 + FeBr2 =FeCl2 + Br2
D.在③反应中当1molCo2O3参加反应时,有2molHCl被氧化
12.某MgCl2溶液的密度为1.18g/cm3,其中Mg2+离子的质量分数为5.1%,300mL该溶液中Cl-离子的物质的量约等于 ( )
A.0.37mol B.0.63mol C.0.74mol D.1.5mol
13.下列根据实验现象所得出的结论正确的是( )
A.钾与水反应比钠与水反应剧烈,结论:钠比钾还原性强
B.将过氧化钠投入到滴有酚酞的水中,溶液先变红后褪色。结论:过氧化钠有强氧化性
C.某物质的水溶液加入盐酸产生无色无味气体,结论:溶液中含有CO32—
D.某物质的水溶液焰色反应呈黄色,结论:该物质是钠盐
14.合成氨工业生产中所用的α-Fe催化剂的主要成份是FeO和Fe2O3,某FeO和Fe2O3混合物中,Fe、O原子的物质的量之比为4:5,则+2价铁与+3铁的物质的量之比为( )
A.2:1 B.1:2 C.4:5 D.1:1
15.a g密度为d1 g/cm3质量分数为ω1的硝酸钾溶液,采取某种措施变成bg密度为d2g/cm3质量分数为ω2的硝酸钾饱和溶液(无硝酸钾析出),下列表达一定正确的是( )
A.a>b B.bω2 ≥aω1 C.d1 >d2 D. a d1ω1= b d2ω2
16.下列物质可通过化合反应直接制得的是
①FeCl2 ②H2SO4 ③NH4NO3 ④H2SiO3
A.只有①②③ B.只有②③ C.只有②③④ D.全部
第Ⅱ卷 非选择题(共52分)
17. (本题5分)回答下列问题:
(1)下图为常见仪器的部分结构(有的仪器被放大)
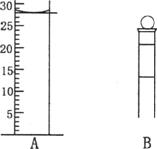
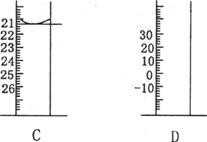
A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为NmL,仰视时读数为MmL,若M>N,则所使用的仪器是 (填字母标号)。
(2)实验室要用98%(ρ=1.84g·cm-3)的硫酸配制3.68mol·L-1的硫酸溶液500mL
①需准确量取98%的硫酸 mL。
②准确量取一定体积的98%的硫酸后,要配制3.68mol·L-1的硫酸溶液500mL,必须用到的实验仪器是(填写序号):
①500mL量筒 ②烧杯 ③1000mL容量瓶 ④500mL 容量瓶 ⑤天平 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒 ⑨酸式滴定管
③若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,所配制的硫酸溶液浓度偏低的是 。
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒。
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.用胶头滴管向容量瓶中加水时溶液凹液面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切。
D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度相切。
18.(本题9分)有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
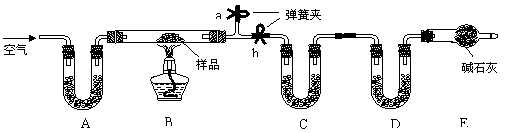
(1)加热前通入空气的目的是 _______________________________________,
操作方法为______________________________________________。
(2)装置A、C、D中盛放的试剂分别为A________,C__________,D_______。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将__________(填
“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定
结果中NaHCO3的含量将________;若撤去E装置,则测得Na2CO3·10H2O的含
量_ __。
(4)若样品质量为 w g,反应后通入一段空气,C、D增加的质量分别为 m1 g、m2 g,由此可知混合物中NaHCO3质量分数为_______________(用含w、m1、m2的代数式表示)
19.(本题共8分) CO、H2和CH4均为常见的可燃性气体。回答下列问题:
(1)等体积的CO、H2和CH4在相同条件下分别完全燃烧,转移的电子数之比是
(2)已知在101 kPa时,CO的燃烧热为283 kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30 倍,CH4完全燃烧反应的热化学方程式是: 。
(3)在密闭容器中充入CO2、CO、H2、CH4的混合气体共mg,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加mg;则CO2与CH4的体积比为 。
(4)由CO、H2和O2组成的混和气体60mL,在一定条件下恰好完全反应,测得生成物在101kPa120℃下对空气的相对密度为1.293,则原混和气体中H2所占的体积分数为 。
20.(本题共3分)已知氨气跟氯气可迅速反应生成氯化铵和氮气。当转移的电子总数为a个时,生成的氮气的物质的量bmol.
(1) 写出该反应配平的化学方程式:
(2)该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为 。
(3)阿伏加德罗数常数为(用含a、b的代数式表示) 。
21.(5分)在某澄清、透明的浅黄色溶液中,可能含有K+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、Cl-离子。进行下述实验(所加试剂均过量)。
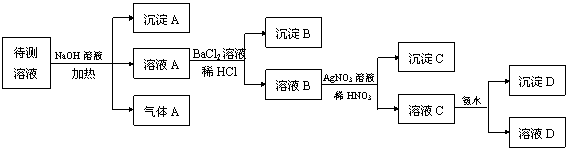 |
(1)气体A的化学式是 ,沉淀A的化学式是 ;
(2)待测液中一定存在 ;
(3)待测液中一定不存在 ;
(4)写出溶液C与过量氨水反应的离子方程式 。
22.(本题8分)化学中用类比的方法可预测许多物质的性质,如根据:H2 + Cl2 = 2HCl推测H2+ Br2=2HBr。但类比是相对的,如根据:2Na2O2+ 2CO2=2Na2CO3+ O2类推:2Na2O2+ 2SO2=2Na2SO3+ O2是错误的,应该为:Na2O2+ SO2=Na2SO4 。
(1).下列各组类比中正确的是___________。
A.由NH4Cl = NH3 ↑+ HCl↑ 推测: NH4I = NH3 ↑+ HI↑
B.由 CO2 + Ca(ClO)2 + H2O = CaCO3 ↓ + 2HClO 推测:
SO2 + Ca(ClO)2 + H2O = CaSO3 ↓ + 2HClO
C.由2CO2 + Ca(ClO)2 + 2H2O = Ca(HCO3)2 + 2HClO推测:
CO2 + NaClO + H2O = NaHCO3 + HClO
D.由 Na2SO3 + 2HCl = SO2 ↑+ 2 NaCl + H2O推测:
Na2SO3 + 2HNO3 = SO2 ↑+ 2 NaNO3 + H2O
(2).根据2NaCl+ H2SO4(浓) = Na2SO4 + 2 HCl ↑的反应,推断例举一个制取类似气体的反应(写出方程式):_______________________________.
(3).由氢氧化铁与盐酸反应生成氯化铁和水,应用有关化学知识,推断写出氢氧化铁与氢碘酸反应的化学方程式:______________________________.
(4).从2F2 + 2H2O = 4HF + O2反应预测2F2 + 4NaOH = 4NaF + 2H2O + O2 ,
然而经试验,物质的量相等的氟气和氢氧化钠正好完全反应,生成氟化钠、
水和放出一种气体,请根据实验结果写出化学反应方程式:____________.
23.(本题8分)由乙烯和其他无机原料合成环状化合物其合成过程如下(水及其他无机产物均已省略):
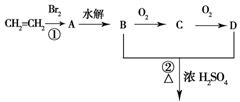
![]()
请分析后回答下列问题:
(1)反应的类型分别是①___________、②________________;
(2)D物质中的官能团为___________________________;
(3)C物质的结构简式___________________,物质X与A互为同分异构体,则X的结构简式为_________________,X的名称为_________________________;
(4)B、D在一定条件下除能生成环状化合物E外,还可反应生成一种高分子化合物,试写出B、D反应生成该高分子化合物的方程式_________________________。
24.(本题6分)
(1).用石墨电解Cu(NO3)2溶液,通电一段时间后,在阴极析出3.2g金属铜,则阳极析出气体__________升.
(2).为了测定某铜银合金的成分,将30g合金溶于80mL13.5mol/L的浓硝酸中,待合金完全溶解后,收到气体6.72L(标准状况),并测得溶液的pH=0,假设反应后溶液的体积仍为80mL,试计算:
①. 被还原的硝酸的物质的量____________mol
② . 合金中银的质量分数___________
化 学 试 卷 答 题 卡
答 题 卡
 | ||
 | ||
| 17.(5分) (1)._______________, ______________ (2).①______________ ②_______________ ③____________ 18.(9分) (1).__________________________________________________________________, _____________________________________________________________________. (2).A____________, C_______________, D__________________. (3)._____________, ________________, _____________. (4).________________. 19.(8分) (1).___________ (2).________________________________________________________________. (3).________________ (4)._________________ 20.(3分) (1).________________________________________________ (2)._________________, (3)._____________________________________. 21.(5分) (1)._____________, ________________________ (2)._______________________________________ (3).___________________________________________ (4)._____________________________________________________________ 22.(8分) (1).______________ (2).________________________________________________________ (3)._________________________________________________________ (4).___________________________________________________________ 23.(8分) (1). ①_______________ ②_________________ (2). ________________ (3).________________ ____________________ _______________________. (4).__________________________________________________________________. 24.(6分) (1).___________ (2).①____________ ② ____________ |
第三次月考化学试题参考答案
1.C 2.C 3.B 4.C 5.D 6.D 7.A 8.D 9.A
10.C 11.D 12.D 13.B 14.D 15.B 16.A
|
(2)100 ②④⑥⑧ ABCD
18.
(1)赶走装置中含有水蒸气和二氧化碳的空气;关闭b,打开a,缓缓通入空气
(2)碱石灰;无水CaC12(或P2O5等);碱石灰
(3)偏低; 无影响;偏低 (4)21m2/11W
19.(1)1:1:4
(2)CH4(g)+2O(g) CO2(g)+2H2O(1);△H=-891kJ/mol
(3)1:1 (4)1/6
20. (1)8NH3+3C12 6NH4C1+N2 (2)3:2
(3)a/6mol-1(没写单位不给分)
21.(1)NH3 Fe(OH)3 (2)NH+4、Fe3+、SO42-、A13+
(3)HCO3-、Ba 2+ (4)A13++3NH3·H2O=A1(OH)3↓+3NH4+
22.(1)C
(2)2NaNO3+ H2SO4(浓) = Na2SO4 + 2 HNO3↑
(3)2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
(4) 2F2 +2NaOH = 2NaF + H2O + OF2↑
23.(1)①加成反应 酯化反应(或“取代反应”)
O
![]() (2)
或羧基
(2)
或羧基
![]() (3)0HC—CHO H3C—CH—Br 1,1—二溴乙烷
(3)0HC—CHO H3C—CH—Br 1,1—二溴乙烷
![]()
|
+2nH2O
24.(1)0.56 (2)0.3 36%
第三次月考化学试题参考答案
1.C 2.C 3.B 4.C 5.D 6.D 7.A 8.D 9.A
10.C 11.D 12.D 13.B 14.D 15.B 16.A
|
(2)100 ②④⑥⑧ ABCD
18.
(1)赶走装置中含有水蒸气和二氧化碳的空气;关闭b,打开a,缓缓通入空气
(2)碱石灰;无水CaC12(或P2O5等);碱石灰
(3)偏低; 无影响;偏低 (4)21m2/11W
19.(1)1:1:4
(2)CH4(g)+2O(g) CO2(g)+2H2O(1);△H=-891kJ/mol
(3)1:1 (4)1/6
20. (1)8NH3+3C12 6NH4C1+N2 (2)3:2
(3)a/6mol-1(没写单位不给分)
21.(1)NH3 Fe(OH)3 (2)NH+4、Fe3+、SO42-、A13+
(3)HCO3-、Ba 2+ (4)A13++3NH3·H2O=A1(OH)3↓+3NH4+
22.(1)C
(2)2NaNO3+ H2SO4(浓) = Na2SO4 + 2 HNO3↑
(3)2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
(4) 2F2 +2NaOH = 2NaF + H2O + OF2↑
23.(1)①加成反应 酯化反应(或“取代反应”)
O
![]() (2)
或羧基
(2)
或羧基
![]() (3)0HC—CHO H3C—CH—Br 1,1—二溴乙烷
(3)0HC—CHO H3C—CH—Br 1,1—二溴乙烷
![]()
|
+2nH2O
24.(1)0.56 (2)0.3 36%
 Y
Y