08年高三化学第一学期期中考试
化 学 试 卷
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32
Cl—35.5 Na—23 Mg—24 Al—27 Fe—56 Cu—64
第I卷 (选择题,共48分)
一、选择题(每小题只有一个正确选项,每题3分,共48分)
1.下列有关环境问题的说法正确的是( )
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4 %的空气有利于人体健康
C.PH在5.6-7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
2.实验室常用湿润的淀粉碘化钾试纸检验Cl2,但湿润的淀粉碘化钾试纸接触到其他气体也会显蓝色,该气体可能是( )
①O3 ②NO2 ③CO2 ④SO2 ⑤HCl ⑥Br2蒸气
A.①③④ B.①②⑤ C.①②⑥ D.②④⑤
3.向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体的一种,经过振荡,现象如下图所示,则甲、乙、丙注入的液体分别是( )
①AgNO3溶液 ②NaOH溶液 ③水
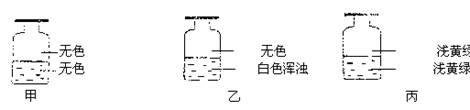 |
A.①②③ B.②①③ C.③②① D.①③②
4.已知HIO既能和酸,又能和碱发生中和反应,则它与盐酸反应的产物是( )
A.IO- B.HI C.ClO- D.ICl
5.下列说法中正确的是( )
A.金属元素的最高价氧化物对应的水化物一定是碱
B.原子形成共价键的数目一定等于该原子的最外层电子数
C.由双原子组成的单质分子一定是非极性分子
D.由非金属元素组成的化合物一定是共价化合物
6.原子序数大于4的主族元素X、Y的离子X m+、Y n- 核外电子排布相同,下列有关X、Y的叙述中正确的是( )
A.X的原子序数小于Y
B.X和Y在同一周期
C.Y的族序数与X的族序数之差是8-(m +n)
D.X、Y的核电荷数之差是 (m-n)
7.某金属元素R原子的质量数为52,已知R离子中含有28个中子,21个电子,由这种离子组成的化合物的化学式正确的是( )
A.RCl2 B.R(OH)3 C.RO2 D.K2R2O7
8.用NA表示阿伏加德罗常数的数值,下列说法不正确的是( )
A.在12g金刚石中,含C—C键的数目为2NA
B.在30gSiO2中,含Si—O键的数目为NA
C.假设硅也能与碳一样形成 “烯烃”,则硅乙烯(SiH2 = SiH2 )和硅丙烯
(SiH2 = SiH— SiH3)的混合物90g中的原子总数9NA
D.常温常压下,硅和NaOH溶液反应产生1molH2,转移电子数2NA
9.下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中,一定没有沉淀生成的是( )
| X | Y | Z | |
| A | NO2 | SO2 | BaCl2 |
| B | NH3 | O2 | Al2(SO4)3 |
| C | NH3 | CO2 | CaCl2 |
| D | CO2 | SO2 | CaCl2 |
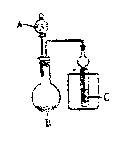
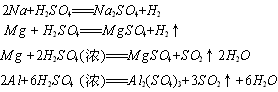 10.用右图所示装置进行实验,将A逐渐滴入B中,若A为浓硫酸;B为第三周期某金属元素的单质,其在常温下难与水反应;C为品红试液,实验中观察到溶液褪色,则B与浓H2SO4反应的化学方程式为( )
10.用右图所示装置进行实验,将A逐渐滴入B中,若A为浓硫酸;B为第三周期某金属元素的单质,其在常温下难与水反应;C为品红试液,实验中观察到溶液褪色,则B与浓H2SO4反应的化学方程式为( )
A.
B.
C.
D.
11.向3L 0.10mol·L-1 H2 SO3 溶液中逐滴滴入0.10mol·L-1 的HNO3溶液,下列所表示的关系正确的是(横坐标为滴入HNO3 溶液的体积)( )
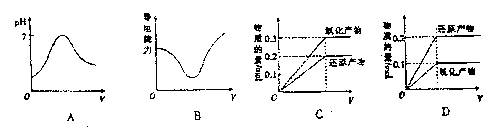 |
12.已知在一定条件下,Cl2、ClO2 ( 其还原产物为Cl- )、O3(1 molO3转化为1 molO2和1 molH2O)、H2O2(1 molH2O2转化为0.5molO2和1molH2O)等物质都具有强氧化性,因而常用做消毒剂。等物质的量的上述物质消毒效率最高的是( )
A.Cl2 B.ClO2 C.O3 D.H2O2
13.对于相同状况下的12C18O和14N2两种气体,下列说法正确的是( )
A.若质量相等,则质子数相等 B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等 D.若体积相等,则密度相等
14.下列各组中的两种物质无论以何种比例混合,其中氯元素的质量分数不变的是( )
A.NaClO和NaCl B.KClO和KCl C.NaClO4和KClO3 D.NaCl和KCl
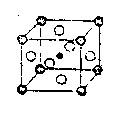 15.最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该新型超导晶体的结构如图所示(碳原子用●球表示,镍原子○表示,镁原子用
15.最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该新型超导晶体的结构如图所示(碳原子用●球表示,镍原子○表示,镁原子用
![]() 球表示),则该晶体的化学式为( )
球表示),则该晶体的化学式为( )
A.Mg2CNi2 B.MgC2Ni
C.MgCNi D.MgCNi3
16.2004年7月德俄两国化学家共同宣布,在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构。已知晶体中N—N键的键能为160KJ/mol,而N![]() N的键能为942KJ/mol。则下列有关说法不正确的是( )
N的键能为942KJ/mol。则下列有关说法不正确的是( )
A.键能越大说明化学键越牢,所构成的物质越稳定
B.高聚氮晶体属于原子晶体
C.高聚氮晶体中n(N)∶n(N-N) = 1∶3
D.用作炸药或高能材料可能是高聚氮潜在的应用
二、填空题
17.(8分) 对于 ![]() ,按下列要求各举一组粒子(即每小题分别写出符合题意的两种粒子)。
,按下列要求各举一组粒子(即每小题分别写出符合题意的两种粒子)。
(1)Z、n、b相同而A不同___________________________
(2)A、n、b相同而Z不同 __________________________
(3)A、Z、b相同而n不同 __________________________
(4)A、Z、n相同而b不同 ___________________________
18.(6分)A、B、C、D四种短周期元素,原子序数依次增大,它们的单质在一定条件下都能与水反应。A元素单质与水蒸气反应的产物是水煤气的主要成分,1 molB元素单质与水反应产生0.5mol气体F,1 molC元素单质与水反应产生0.5mol气体E,E、F相互化合生成水,D元素单质与水反应生成两种酸。
(1)B单质与水反应的化学方程式为___________________________________
(2)C与D所形成的化合物,其晶体的粒子间以 _______________键相结合,一个D粒子周围与D粒子距离相等且最近的C粒子有 ________个。A与D所形成的化合物,其晶体的粒子间以______________相结合。
(3)四种元素中最高价氧化物水化物酸性最强的是_______________。(填化学式)
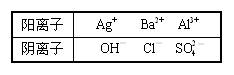 19.(10分)现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
19.(10分)现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
为鉴别它们,分别完成以下实验,其结果是:
a.B和D都不溶于水,也不溶于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀;
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀
d.E溶于水后,与上述某阳离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀量减少,但不消失。请根据上述实验结果,填空:
(1)写出化合物的化学式:
A____________,C ____________,D ___________,E _____________ ;
(2)A溶液与过量的E溶液反应后,最终得到的沉淀的化学式是_____________。
20.(8分)下图是中学化学常见物质之间的相互转化关系(部分生成物略去),反应①-⑥均为氧化还原反应。其中C、D在常温下是气体单质,其余均为化合物;常温下D是一种黄绿色气体,B是一种无色液体,A、E、G、H的焰色反应呈紫色,且A、G、H含有相同的两种元素,反应⑤生成的A与H的物质的量之比为1∶3。
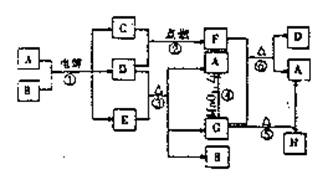 |
请回答下列问题:
(1)写出A的电子式:_______________ 。
(2)常温常压下,若1 mol气体F完全分解需要吸收92.3kJ热量,则气体C在气体D中燃烧的热化学方程式为 _______________________________________。
(3)写出下列反应的化学方程式:
⑤______________________________________________
⑥______________________________________________
21. (10分)为探究SO2和NaOH溶液确实发生了化学反应,某实验小组的同学设计了下列三种实验装置。
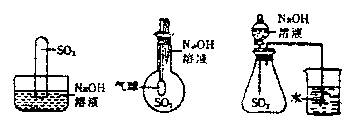 |
(1)写出SO2与过量NaOH溶液反应的离子方程式:________________________ ;
(2)从实验装置I、II、III中任意选择一种,简述出现的实验现象:选择的实验装置是________,实验现象为________________________________________;
(3)某同学质疑上述实验设计,该同学质疑的依据是_______________________;
(4)设计最简单的实验,证明实验I的试管中SO2和NaOH肯定发生反应______
____________________________________________________________________。
22.A、B、C、D为短周期元素。A元素原子的次外层电子数是最外层电子数的1/2,B的阴离子核外只有一个电子层,C单质在标态下的密度为1.43g/L,D元素的焰色反应呈黄色。将以上四种元素组成的结晶水盐3.4g加热到完全失去结晶水,其质量减少1.35g,所得无水盐中C元素的质量分数为39%。将该无水盐与适量盐酸作用得到一种弱酸,再将所得弱酸完全燃烧得0.9g水和1.12L(标)CO2,已知这种弱酸一个分子中共有32个质子。回答:
(1)四种元素各是什么元素,A______,B _____,C______,D_______。
(2)结晶水盐的化学式: ____________________________________________。
化 学 试 卷  答 题 卡
答 题 卡
 | ||
 | ||
| 17.(8分) (1) _______________ (2) ______________ (3) _______________ (4) ______________ 18.(6分) (1) __________________________________________________________________ (2) ________________ _________________ __________________ (3) ________________ 19.(10分) (1) A_____________ C_____________ D_____________ E_____________ (2) ___________________________ 20.(8分) (1) _________________________ (2) ________________________________________________ (3) ⑤_____________________________________________________ ⑥_____________________________________________________ 21.(10分) (1) _____________________________________ (2) _________________,___________________________________________ (3) __________________________________________________ (4) ___________________________________________________ 22.(10分) (1) A_____________ B_____________ C_____________ D_____________ (2) ___________________________ |
 化学试卷参考答案
化学试卷参考答案