高三化学第一学期期末模拟试卷
高 三 化 学
说明:考试时间100分钟,总分120分。
第Ⅰ卷(选择题)答案填涂答题卡,第Ⅱ卷(非选择题)答案填写在答卷纸相关空格处。
可能用到的相对原子质量:C 12 S 32 O 16 H 1 Cl 35.5 Fe 56 Mg 24 As 75
第Ⅰ卷(选择题 共 48 分)
一、选择题(本题包括8小题,每小题只有一个选项符合题意,每小题3分,共24分)
1.化学是一门实用的、中心的学科,生活中的许多问题常涉及到化学知识。它在给经济发展
和群众生活带来方便的同时,也产生负面的影响。下列有关叙述不正确的是
A.次氯酸和臭氧都是强氧化剂,都能杀死水中的细菌。自来水常用氯气来杀菌消毒,是因为氯气杀菌消毒效果要比臭氧好,且不会残留有毒、有害物质
B.人们应用原电池原理,制作了多种电池,如干电池、充电电池、高能电池等。电池在现代生产和科学技术中发挥了重要作用,但废旧电池会对生态环境和公众健康造成危害。所以废旧电池必须回收再利用
C.明矾常用作净水剂,但人体摄入大量铝盐,易患“老年性痴呆”,所以明矾不能大量作净水剂使用
D.氟氯烃为一类含有氟和氯的有机物,是制冷效果极佳的致冷剂,但它会破坏臭氧层,科研人员正在积极研发环保型的替代产品以减少氟氯烃的使用量
2.下列关于反应类型关系正确的是
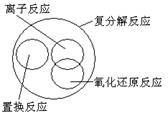
 A. B.
A. B.
 C.
D.
C.
D.
3.下列叙述正确的是
 A.为提醒人们在使用浓H2SO4时要注意安全,贮存浓H2SO4的容器上贴有下图标识。
A.为提醒人们在使用浓H2SO4时要注意安全,贮存浓H2SO4的容器上贴有下图标识。
B.实验室可通过蒸馏的方法除去自来水中含有的Cl-等杂质制蒸馏水。
C.做焰色反应实验时,应先将铂丝(或铁丝)用稀硫酸洗净后,在酒精灯外焰上灼烧至没有颜色时,再醮取待检溶液进行实验。
D.由于碱金属单质化学性质活泼,实验室中的各种碱金属单质均保存在煤油中。
4.下列离子方程式正确的是
A.漂白粉溶液中通入二氧化硫:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
B.将1molCl2通入含1molFeBr2的溶液中:2Cl2+2Fe2++2Br-=Br2+2Fe3++4Cl-
C.碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O
D.水玻璃(硅酸钠水溶液)中滴加稀盐酸:Na2SiΟ3+2H+=H2SiO3↓+2Na+
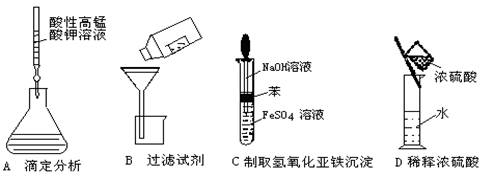
5.下列操作或仪器的选用正确的是
6.下列说法正确的是
A.自发反应一定是△H小于0的反应
B.自发反应一定是△S大于0的反应
C.丁达尔效应是区分胶体和溶液的一种常用物理方法
D.硫酸钡在一定条件下可转化为碳酸钡,说明硫酸钡在此条件下的Ksp一定大于碳酸钡的Ksp
7.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M 关于该反应的说法中正确的组合是
① 氧化剂是H3AsO3; ② 还原性:Cl->As;③ 每生成7.5gAs,还原剂失去的电子为0.3mol;④ M为OH-;⑤ SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
8.始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如右图,其中
R1、 R2为烷烃基。则下列有关始祖鸟烯的说法中正确的是
R2为烷烃基。则下列有关始祖鸟烯的说法中正确的是
A.始祖鸟烯与乙烯互为同系物
B.若R1=R2=CH3,则其化学式为Cl12H16
C.若R1=R2,一定条件下烯烃双键碳原子上的氢也能取代,则始祖鸟烯环上的二氯代物有10种
D.始祖鸟烯既能使酸性高锰酸钾褪色也能使溴水褪色,其褪色原理是一样的
二、选择题(本题包括6小题,每小题4分,共24分,每小题有1-2个选项符合题意。)
9.用NA表示阿伏加德罗常数,下列说法正确的是
A.71g氯气与过量的铁粉完全反应转移的电子数为3NA
B.1 molSiO2晶体中含有共价键的数目是4NA
C.标准状况下,2.24L三氧化硫所含的分子数为0.1NA
D.1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA
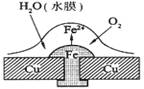 10.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是
10.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是
A.正极电极反应式为:2H++2e—=H2↑
B.此过程中还涉及到反应:
4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
11.A、B、C为三种短周期元素,A、B在同周期, A、C的最低价离子分别为A2-和C-,
B2+和C-具有相同的电子层结构。下列说法中正确的是
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
12.下列溶液中有关微粒的物质的量浓度关系正确的是
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):
c(Na+)=c(HRO3-)+2c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
c(Na+)>c(Cl—)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<②
D.等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前<N后
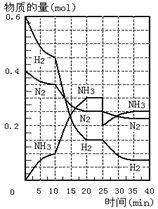 13. 500℃、20MPa时,将H2和N2置于一容积为2L的密闭
13. 500℃、20MPa时,将H2和N2置于一容积为2L的密闭
容器中发生反应。反应过程中H2、N2和NH3物质的量变化如
右图所示,下列说法正确的是
A.反应开始到第一次平衡时,N2的平均反应速率为 0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至20min时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至25min时,分离出0.1mol的氨气
D.在25min时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
14.将2.4gFe、Mg合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体VL(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6g。则收集到的气体体积V的值不可能为
A.6.72 B.1.12 C.1.OO D.0.986
张家港高级中学2007-2008学年第一学期期末模拟试卷
高 三 化 学
第Ⅱ卷(非选择题 共72分)
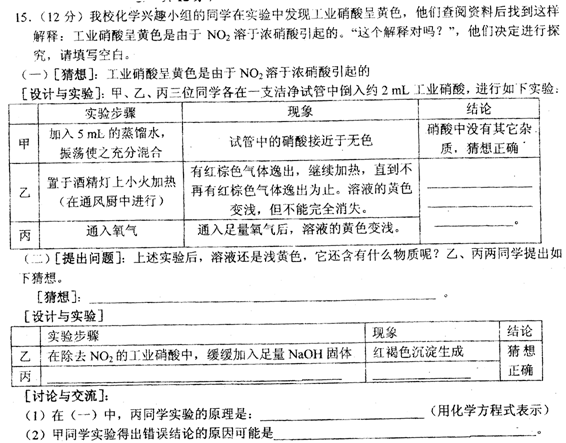 三、(本题包括1小题,共 12 分)
三、(本题包括1小题,共 12 分)
四、(本小题包括2小题,共 20分)
16. (8分)工业“从海水中提取镁”的流程图如下:
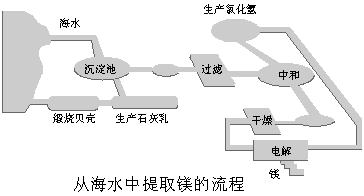
步骤为:
① 将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
② 将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③ 在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
④ 将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
⑤ 电解熔融的氯化镁可得到Mg。
请回答以下问题:
(1) 步骤③中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有 、 、酒精灯、铁架台等。
(2) 步骤④中的“一定条件”指的是 ,目的是 。
(3) 上述提取镁的流程中,在降低成本、减少污染方面做了一些工作,请写出其中一点:
。
(4) 有同学认为:步骤②后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?为什么?
你的观点是 。理由是 。
17.(12分)短周期元素形成的纯净物A、B、C、D、E转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。

请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的化学式 。
(2)若E的水溶液呈现弱酸性,D是既能溶于强酸、又有溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因(仅写出电离方程式即可)。
。
②用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系
。
(3)若C是一种气体,D是一种强酸,则:
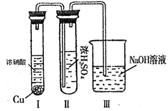 ①C与水反应的化学方程式为
。
①C与水反应的化学方程式为
。
②有人认为“浓H2SO4可以干燥气体C”。某同学
为了验证该观点是否正确,用右图装置进行实验。
实验过程中,浓H2SO4中未发现有气体逸出,且变
为红棕色,则你得出的结论是 。
③已知常温下物质A与物质B生成1mol气体C的焓变为 -57kJ/mol, 1 mol气体C与H2O反应生成D溶液和E气体的焓变为 -46kJ/mol,写出物质A与物质B及水生成D溶液的热化学方程式 。
五、(本题包括2小题,共 18 分)
18.(8分)已知A为芳香烃的衍生物,只含C、H、O三种元素,苯环上只有两种取代基,并且这两种取代基处于邻位,A的相对分子质量为164。A不能使FeCl3溶液变色,但可被银氨溶液氧化为B;B能在浓H2SO4存在和加热条件下发生分子内的酯化反应生成C,C分子中除苯环外还有一个含氧的六元环(与苯环共用2个C原子)。
(1)B分子中的含氧官能团是 、 (用化学式表示)。
(2)已知醛基(—CHO)是一个平面结构,则醛基中C原子的杂化方式是 杂化。A的侧链核磁共振氢谱有 个信号峰。
(3)试写出A及其对应的C的结构简式各一种:A C
19.![]()
![]() (10分)部分有机物之间的转化关系以及转化过程相对分子质量变化关系如下:
(10分)部分有机物之间的转化关系以及转化过程相对分子质量变化关系如下:
物质转化关系:R-CH2OH RCHO RCOOH
相对分子质量: M M-2 M+14
已知:物质A中只含有C、H、O三种元素,一定条件下能发生银镜反应,物质C的相对分子质量为104。A与其他物质之间的转化关系如下图所示:
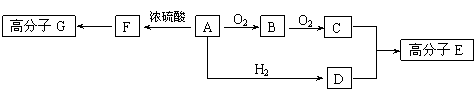 |
请回答下列问题:
⑴A→F和C+D→E的反应类型分别为: 、 。
G的结构简式为: 。
⑵一定条件下B发生银镜反应的化学方程式 。
⑶由C、D在一定条件下反应还能生成环状化合物,其化学反应方程式为 。
⑷A的同分异构体很多,写出两种与A中所含官能团不同,但能与NaOH溶液反应的A的同分异构体的结构简式: 、 。
六、(本题包括1小题,共 10 分)
20.(10分)现代炼锌的方法可分为火法和湿法两大类。
火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
焙烧炉中:2ZnS+3O2=2ZnO+2SO2 ①
鼓风炉中:2C+O2=2CO ②
鼓风炉中:ZnO(s)+CO(g) ![]() Zn(g)+CO2(g) ③
Zn(g)+CO2(g) ③
⑴请写出反应③的平衡常数表达式 ,若在其它条件不变时,在鼓风炉中增大CO的浓度,平衡将如何移动? ,此时平衡常数
(填“>”“<”或“=”)原平衡常数。
⑵已知闪锌矿中含硫16%(其它杂质不含硫),则闪锌矿中硫化锌的含量为 。
⑶焙烧炉出来的混合气体中N2占85%,鼓风炉中反应③CO的转化率为80%,计算每生
产1molZn,消耗标准状况下空气的体积共为多少L?(假设矿石中的ZnS全部转化为Zn
反应中的O2均来自于空气,空气中O2与N2的体积比以1:4计算))
七.选做题(本题包括2小题,任意选做一题,若A、B都做,则以A题计分。共12分)
21A.[物质结构与性质]
(1)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p亚层上有3个电子。
 ①写出甲元素的电子排布式_______ _,下列各化合物分子中甲元素的原子杂化方式全部相同的是________________(填序号)。
①写出甲元素的电子排布式_______ _,下列各化合物分子中甲元素的原子杂化方式全部相同的是________________(填序号)。
②甲、乙元素可形成硬度大于金刚石的一种化合物,该化合物属于____________晶体,其化学式为_______________。
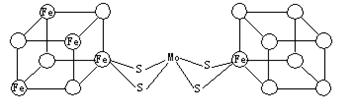
(2)人们一直致力于人工固氮的研究以获得廉价的氮肥。科学家先后提出并合成了出固氮酶的多种模拟物。其中一类是含Mo、Fe、S原子的类立方体结构,如下图所示。
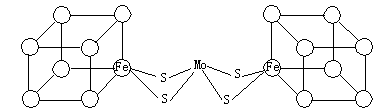 |
图中左右两边对称,各含一个近似为立方体的结构。每个立方体含有4个Fe原子、4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键。
①请在图中左边立方体的○中填写出其余3个Fe原子。
②上述一个立方体中4个Fe原子所在的顶点连接所构成的空间几何体为___________。
 21B.[实验化学]
21B.[实验化学]
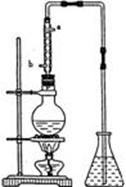
市售乙醛通常为40%左右的乙醛溶液。久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液。据测定,上层物质为乙醛的加聚物作(C2H4O)n,它的沸点比水的沸点高,分子中无醛基。乙醛在溶液中易被氧化。为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n →
nC2H4O。
(1)先把混合物分离得到(C2H4O)n;将混合物放入分液漏斗,分层清晰后,分离操作是 ____________________
(2)若将少量乙醛溶液滴入浓硫酸中,生成黑色物质。请用化学方程式表示这一过程: ________________________________________
(3)提取乙醛的装置如右图;烧瓶中放的是(C2H4O)n和6 mol·L- H2SO4的混合液,锥形瓶中放蒸馏水。加热至混合液沸腾,(C2H4O)n缓慢分解,生成的气体导入锥形瓶的水中。
①用冷凝管的目的是_____________ 。
②锥形瓶内导管口出现的气泡从下上升到液面的过程中,体积越来越小,直至完全消失,这现象说明乙醇的何种物理性质? ____
当观察到导管中的气流已很少时,必要的操作_
③若n=3,则(C2H4O)n的结构简式是:________________ ___
高 三 化 学 答 卷 纸

注意:将选择题答案涂到答题卡上!
15.(12分)
(一)[设计与实验]
乙、丙结论:
(二)[猜想]:
[设计与实验]
丙实验步骤:
现象:
[讨论与交流]
(1)(一)中丙的实验原理(用化学方程式表示):
(2)甲得出错误结论的原因:
16. (8分)
(1) 需要的主要仪器有 、 。
(2) 步骤④中的“一定条件”指的是 ,
目的是 、 。
(3) 。
(4) 你的观点是 。
理由是 。
17.(12分)
(1) 。
(2)① 。
② 。
(3)① 。
② 。
③ 。
18.(8分)
(1) 、 (用化学式表示)。
(2) 。 。
(3)A C
19.(10分)
⑴ 反应类型分: 、 。结构简式: 。
⑵ 。
⑶ 。
⑷ 、 。
20.(10分)
⑴ , , (填“>”“<”或“=”)。
⑵ 。
| |
21A.(12分)(21A、21B任意选做一题,若A、B都做,则以A题计分。)
(1)① _______ _, ________________(填序号)。
② _________ ___, _______________ 。
(2)①
②___________。
21B.(12分)
(1) ________ ____________
(2)___________________________________________________
(3) ① _____________ 。
② ____
,_
。
③________________ ___
参考答案
一、选择题(本题包括8小题,每小题只有一个选项符合题意,每小题3分,共24分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | C | B | B | C | C | A | C |
二、选择题(本题包括6小题,每小题4分,共24分,每小题有1-2个选项符合题意)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | B | A | AC | AD | BC | A |
三、(本题包括1小题,共 12 分)
15.(一) 呈黄色的工业硝酸中存在二氧化氮气体,还含有其它呈黄色的杂质
(二)[猜想]:可能含有Fe3+
[设计与实验]:在加热除去NO2的硝酸中加入KSCN溶液;溶液呈血红色
[讨论与交流]:(1)4NO2 + O2 + 2H2O == 4HNO3
(2)可能是由于水将工业硝酸的黄色冲淡了
四、(本小题包括2小题,共 18 分)
16.(8分)⑴蒸发皿,玻璃棒;(2分)
⑵在HCl气流中,(1分)抑制MgCl2水解成Mg(OH)2;带走水蒸气;(2分)
⑶电解产生的Cl2用于制取HCl气体;(1分)
⑷不同意。(1分)
因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本(1分)
17.(12分)
(1)Na2O2 (2分)
(2)① H++H2O+AlO2-![]() Al(OH)3
Al(OH)3 ![]() Al3++3OH- (2分)
Al3++3OH- (2分)
② c(Na+)+c(H+) = 2c(S2-)+c(HS-)+c(OH-) (2分)
(3)①3NO2+H2O = 2HNO3+NO (2分)
②NO2能溶于浓硫酸中,浓硫酸不能干燥NO2 (2分)
③4NO(g)+3O2(g)+2H2O(l)= 4HNO3(aq) △H = - 618 kJ/mol (2分)
五、(本题包括2小题,共 18 分)
18.(1)-COOH、-OH (共2分)(2)sp2 (2分) 5 (1分)
(3) A
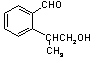 C
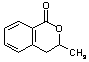
C 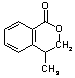 或 A
或 A 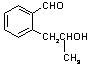 C
C
19.(11分)消去反应、缩聚反应(2分)
![]()
![]() (2分)
(2分)
OHC-CH2-CHO+4Ag(NH3)2OH 4Ag+NH4OOC-CH2-COONH4+6NH3+2H2O(2分)
 HOCH2CH2CH2OH+HOOCCH2COOH
HOCH2CH2CH2OH+HOOCCH2COOH
![]() +2H2O(2分)
+2H2O(2分)
CH3CH2COOH CH3COOCH3 HCOOCH2CH3(2分)
六、(本题包括1小题,共 10 分)
![]() 20.(10分)
20.(10分)
⑴ (2分)右移 (1分) = (1分)
⑵48.5% (3分)
⑶260.4L (3分)
七、(本题包括2小题,共 12 分)
21A.
(1)①1s22s22p2 ce ② 原子 C3N4
(2)①
|
②正四面体(答四面体也给分)
21B.
(1)打开分液漏斗活塞,将下层液体放入烧杯内,把上层液体从分液漏斗上口倒出
(2)CH3CHO + H2SO4 → 2C + SO2↑+ 3H2O
(3)① 使水蒸气冷凝回流,防止硫酸浓度变大以免乙醛被氧化
② 易溶于水;及时撤除导管,防止发生倒吸
③ 略