高三化学第一学期期末测试试卷
第Ⅰ卷(选择题共50分)
| 考 生 须 知 | 1.考生要认真填写第Ⅱ卷卷头。 2.第Ⅰ卷为选择题,只有一道大题。答题前要认真审题,看清题目要求,将答案填在第Ⅱ卷的答题表中。 3.考试结束后,考生应将第Ⅱ卷交监考老师收回,第Ⅰ卷由自己妥善保存。 |
可能用的相对原子质量:H:1 Fe:56 P:31 C:12 N:14 O:16
Na:23 Mg:24 Al:27 S:32 Cl:35.5 K:39 Cu:64 Zn:65
一、选择题(每小题只有一个选项符合题意。本大题共25个小题,每小题2分,共50分)
1.科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等它们互称为:
A.同系物 B.同分异构体 C.同素异形体 D.同位素
2.下列物质的水溶液能导电,但属于非电解质的是
A. CH3CH2COOH B.Cl2 C.NH4HCO3 D.SO2
3.下列物质加入水中,使水的电离程度增大,且所得溶液显酸性的是
A.CH3COOH B.Al2(SO4)3 C.NaOH D.Na2CO3
4.下列各组物质的晶体,化学键类型相同,晶体类型也相同的是
A.SO2和SiO2 B.CO2 和NaCl
C. NH4Cl 和HCl D. H2O2和C3H6
5.下列各分子中,所有原子都满足最外层为8电子结构的是
A.H2O B.BF3 C.CCl4 D. PCl5
6.1 g氢气燃烧生成液态水,放出142.9 kJ热量,下列表示该反应的热化学方程式正确的是
A.H2(g)+ ![]() O2(g)==H2O(l ), △H= -285.8 kJ/mol
O2(g)==H2O(l ), △H= -285.8 kJ/mol
B.2H2(g)+O2(g)=2H2O(l), △H= -142.9 kJ/mol
C.2H2+O2=2H2O, △H= -571.6 kJ/mol
D.2H2(g)+O2(g)=2H2O(l), △H= +571.6 kJ/mol
7.在容积不变的密闭容器中,反应2SO2+O2![]() 2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为
2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为
A.0.1s B.2.5s C.5s D.10s
8.下列关于铜电极的叙述中正确的是
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时用粗铜作阳极
C.在镀件上电镀铜时用铜作阴极
D.电解稀硫酸时用铜作阳极,阳极产物为氧气
9.下列说法错误的是
A. 用稀盐酸清洗做焰色反应的镍铬丝
B. 用酒精萃取碘水中的碘
C. 用稀硝酸洗去残留在试管壁上的铜
D. 用碱石灰吸收氨气中的水蒸气
10.聚氯乙烯简称PVC, 是当今世界上产量最大、应用最广的热塑性塑料之一。下列说法正确的是
A.聚氯乙烯的单体是CH3CH2Cl
B.聚氯乙烯是高分子化合物
C.聚氯乙烯能够使溴的四氯化碳溶液褪色
D.聚氯乙烯塑料薄膜最适合用来包装蔬菜、水果及熟食
11.用NA表示阿伏加德罗常数,下列叙述中正确的是
A. 0.1 mol·L-1稀硫酸100mL中含有硫酸根个数为0.1NA
B. 1mol CH3+(碳正离子)中含有电子数为10NA
C. 2.4g金属镁与足量的盐酸反应,转移电子数为2NA
D. 12.4g白磷中含有磷原子数为0.4NA
12.相同温度下等物质的量浓度的下列溶液中,pH值最小的是
A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
13俄罗斯科学家在利用回旋加速器进行的实验中,用含20个质子的钙元素的同
位素反复轰击含95个质子的镅元素,结果4次成功制成4个第115号元素的原子。这4个原子在生成数微秒后衰变成第113号元素。前者的一种核素为![]() 。下列有关叙述正确的是
。下列有关叙述正确的是
A.115号元素衰变成113号元素是化学变化
B.核素![]() 的质量数与质子数之和为173
的质量数与质子数之和为173
C.113号元素属于非金属元素
D.115号元素的最高正化合价是 +5
14.右图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是
A.大理石和稀硫酸制取二氧化碳
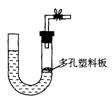 B.锌粒和稀硫酸制氢气
B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气
D.电石和水制取乙炔
15. 某实验小组学生按照课本实验要求,用50 mL 0.5 mol/L的盐酸与50 mL 0.55 mol/L的NaOH 溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。下列说法正确的是
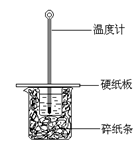 A.实验过程中没有热量损失
A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用 60 mL 0.50 mol/L的盐酸跟
50 mL0.55 mol/L的NaOH溶液进行反
应,从理论上说所求中和热不相等。
16.下列实验操作中,合理的是
A.实验室制乙烯时,在酒精和浓硫酸的混合液中,放入几片碎瓷片,加热混合物,使液体温度迅速升到170 ℃
B.实验室制取肥皂时,待植物油、乙醇和氢氧化钠溶液的混合物加热充分反应后,冷却,用纱布滤出固态物质
C.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置,待液体分层后,滴加硝酸银溶液
D.验证蔗糖水解产物时,在蔗糖溶液中加入几滴稀硫酸,水浴5 min,加入新制银氨溶液
17.下列离子方程式书写正确的是
A.氢氧化铁溶于氢碘酸: Fe(OH)3 +3H+ == Fe3+ +3H2O
B.次氯酸钙溶液中通入过量的CO2:
Ca2+ +2ClO—+CO2 +H2O ==CaCO3↓+2HClO
C.向FeBr2溶液中通入少量Cl2: 2Fe2+ +Cl2 ==2Fe3+ +2Cl—
D.向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+刚好沉淀完全:
Al3+ +SO42—+Ba2+ +3OH—==BaSO4↓+Al(OH)3↓
18.X、Y是元素周期表ⅦA族中的两种元素,下列叙述中能说明X的非金属性比Y强的是
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.用石墨做电极电解等物质的量浓度的NaX和 NaY的混合溶液,X -先被氧化
19.常温下,向一定浓度的氨水中逐滴加入盐酸,在此过程中,下列说法正确的是
A.当pH>7时,c(Cl—)>c(![]() )>c(OH—)
>c(H+)
)>c(OH—)
>c(H+)
B.当pH=7时,c(![]() )>c(Cl—)>c(H+)=c(OH—)
)>c(Cl—)>c(H+)=c(OH—)
C.当pH<7时,c(![]() )>c(Cl—)>c(H+)>c(OH—)
)>c(Cl—)>c(H+)>c(OH—)
D.当氨水与盐酸恰好完全反应时,c(Cl—)>c(![]() )>c(H+)>c(OH—)
)>c(H+)>c(OH—)
20.在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是( )
A.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含
Cu2+
B.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+
C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含有Cu2+和Fe3+
D.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+
21.下列叙述正确的是:
A. 直径介于1nm~10nm之间的微粒称为胶体
B. 电泳现象可证明胶体属于电解质溶液
C. 利用丁达尔效应可以区别溶液与胶体
D. 胶体粒子很小,可以透过半透膜
22.下列各组离子,在指定的环境中能够大量共存的是
A.有Fe3+ 大量存在的溶液中:Na+、Cl-、K+、SCN-
B.滴加酚酞显红色的溶液中:NH4+、Al3+、SO42-、NO3-
C.常温下pH=1的溶液中: Na+、K+、Cl-、ClO-
D.有CO32-存在的无色透明溶液中:Na+、K+、Cl-、AlO2-
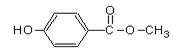 23.尼泊金甲酯可在化妆品中作防腐剂。结构简式为
23.尼泊金甲酯可在化妆品中作防腐剂。结构简式为
下列说法中不正确的是
A.该物质属于芳香烃
B.该物质的分子式为C8H8O3
C.该物质能够和FeCl3反应,使溶液呈紫色
D.在一定条件下,1 mol该物质最多能和2 mol NaOH反应
24.在一定温度不同压强(p1<p2)下,可逆反应2X(g) ![]() 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(![]() )与反应时间(t)的关系有以下图示,正确的是
)与反应时间(t)的关系有以下图示,正确的是
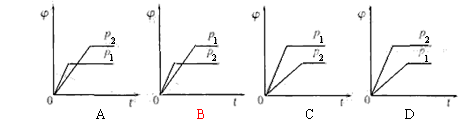 |
25.下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如右图所示),一定没有沉淀生成的是
| X | Y |
| |
| A | NO2 | SO2 | BaCl2 |
| B | NH3 | O2 | Al2(SO4)3 |
| C | NH3 | CO2 | CaCl2 |
| D | CO2 | SO2 | CaCl2 |
第Ⅱ卷
二、
26.(15分)现有aA、bB、cC、dD、 eE五种短周期元素,A、B、C、D都是生命体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c a+c=d ,B、D都有同素异形体。人类已知的化合物中,有一类化合物的种类已超过三千万,这类化合物中一般都含有A、B两种元素。E是一种生活中常用的金属。根据以上信息,回答下列有关问题:
(1)写出下列元素的元素符号:B__________ D__________ E ____________。
(2)若由上述五种元素中的两种元素组成化合物,化合物分子中分子的空间构型为直线型。写出符合上述要求且原子数不少于3的任意两种化合物的电子式:__________、_________。
(3)写出由上述五种元素中的四种元素组成的离子化合物的化学式(写出两种即可)______________________、________________________。
(4)在A、B、D三种元素中选择两种或三种元素组成两种可以发生反应的阴离子,请写出该反应的离子方程式__________________________________________________________。
(5)E用于焊接钢轨时的化学方程式为:________________________________________。
(6)A单质与C单质的化合反应是化学工业中的一个重要反应,写出该反应的化学方程式:_________________________________________________________________________。
(7)由A、B、D三种元素按照原子个数比6︰2︰1组成的化合物甲可与D单质构成燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液,两极分别通入化合物甲和D单质,写出该电池的正极反应式和总反应方程式:
正极:_____________________________________________________________________。
三、
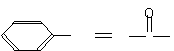
 27.今年是杰出的奥地利化学家约瑟夫·劳施密特逝世110周年,1861年他著的《化学研究》第一卷中就有如下左图物质圈图,即肉桂酸结构(如右侧图)
27.今年是杰出的奥地利化学家约瑟夫·劳施密特逝世110周年,1861年他著的《化学研究》第一卷中就有如下左图物质圈图,即肉桂酸结构(如右侧图)![]()
CH CH C OH
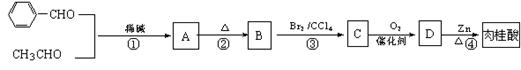
肉桂酸的合成路线如下:
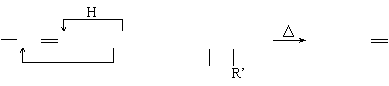
|
 已知:
已知:
|
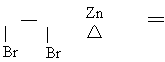 2RCH CHR’
2RCH CHR’![]() RCH CHR’
RCH CHR’
|
试回答下列问题:
(1)B的侧链上可能发生反应的类型是:__________________(填序号)。
A.加成反应 B.氧化反应 C.水解反应 D.还原反应
1molB最多能与__________________molH2发生加成反应。
(2)D的结构简式为: 。C中含氧官能团的名称是___________。
(3)属于消去反应的有: (填序号)。
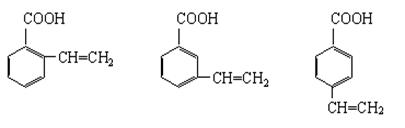
(4)与肉桂酸互为同分异构体且能使溴的四氯化碳溶液褪色还能与碳酸氢钠溶液反应的同分异构体有(写结构简式): 、 、
、 。
(5)肉桂酸苄酯是一种重要的定香剂,是由肉桂酸与苯甲醇反应得到的,写出该反应的
化学方程式: 。
四、
28.某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所
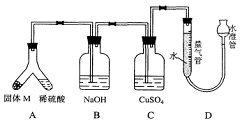 得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)。
得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)。
注意:CuS是既不溶于水也不溶于酸的黑色沉淀。
由上述实验事实可知:
(1)①固体M中一定有的物质是______________(填化学式) ,理由是
_______________________________________________________________________。
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是________。
写出B装置中反应的离子方程式_______________________________________。
(3)C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是____________________________________________________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。
五、
29.(6分)
向1.0 L pH = 12的Ba(OH)2溶液中,逐滴加入1.25×10-3 mol/L 的NaHSO4溶液,使溶液中的Ba2+ 恰好完全沉淀时(忽略溶液混合时体积的变化),所得溶液pH = ,发生反应的离子方程式为: 。当溶液呈中性时,加入NaHSO4溶液的体积是 L,反应的离子方程式为__________________________________________________________________________。
高三化学试卷参考答案 2008年 1月
一、
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | C | D | B | D | C | A | C | B | B | B | D | C | D |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 | B | B | A | C | C | D | B | C | D | A | B | D |
二、26:(15分)(1)--(3)每空1分,(4)--(7)每空2分
(1)B.C D.O E.Al
(2)二氧化碳、乙炔等直线型分子的电子式
(3)NH4HCO3 (NH4)2CO3等。
(4)HCO3-+ OH-== H2O + CO32-
(5)2Al+Fe2O3
![]() Al2O3 + 2Fe
Al2O3 + 2Fe
(6) N2
+ 3H2![]() 2NH3
2NH3
(7) 正极:O2 + 4e- + 2H2O == 4OH-
三、27(共14分)(1)ABD(3分),5 (1分)
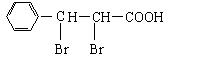 (2)
(2)
醛基(1分)。
(3) ②④(2分)
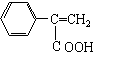 (4)
(4)
(2)(4)每空1分
![]()
(2分)(结构简式错误,水或条件漏写,均不给分)
四、28.(共13分)
(1)①FeS、Fe(2分) B装置增重、量气管有气体(2分)。
② V/400(1分)
(2)洗气瓶(1分) 2OH-+H2S== 2H2O+S2-(2分)
(3)证明H2S已被完全吸收(1分) 黑色沉淀(1分)
(4)硫(1分) 漏斗、玻璃棒(2分)
五、29.(8分,每空2分)11 (2分)
H+ + SO42- + Ba2+ + OH- = BaSO4↓+ H2O (2分)
8 (2分)
2H+ + SO42- + Ba2+ +2OH- = BaSO4↓+2H2O (2分)
 Z
Z