高三化学第一次月考试卷
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 满分 | 48 | 25 | 17 | 10 | 100 |
| 实得分 |
有关元素的相对原子质量:H~1 O~16 Fe~56 S~32 C~12 N~14 Cl~35.5
一、选择题:(共3×16=48分,15、16两小题有2个答案,其余只有一个答案)
1.某学生的实验报告中有下列数据:①用托盘天平称取11.7 g食盐 ②用量筒量取21.48 mL盐酸 ③用容量瓶配制216 mL 1 mol·L-1硫酸溶液 ④用标准NaOH溶液滴定未知浓度的盐酸,用去了21.20 mL NaOH溶液,其中数据合理的是
A.①④ B.②④ C.①③ D.②③
 2.已知由AgNO3溶液和稍过量的KI溶液制得的AgI溶胶跟Fe(OH)3溶胶相混合时,会析出AgI和Fe(OH)3的混合沉淀。由此可知
2.已知由AgNO3溶液和稍过量的KI溶液制得的AgI溶胶跟Fe(OH)3溶胶相混合时,会析出AgI和Fe(OH)3的混合沉淀。由此可知
A.该AgI胶体粒子带正电荷
B.该AgI胶体粒子电泳时向阴极移动
C.该AgI胶体粒子带负电荷
D.Fe(OH)3胶体粒子电泳时向阳极移动
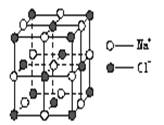
3.右图是构成氯化钠晶体的一个晶胞(构成晶体的最小重复单位),从统计的角度看,该晶胞含Na+和Cl-的个数分别为
A.1、1 B.4、4 C.14、13 D.14、14
4.下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是
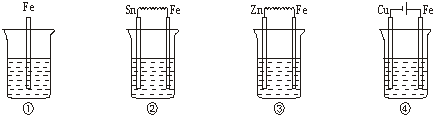
A.④>②>①>③ B.②>①>③>④
C.④>②>③>① D.③>②>④>①
5.科学家成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2原子晶体的说法正确的是
A.CO2原子晶体和CO2分子晶体互为同素异形体
B.在一定条件下,CO2原子晶体转化为分子晶体是物理变化
C.CO2原子晶体和CO2分子晶体具有相同的物理性质
D.在CO2原子晶体中,每一个碳原子周围结合四个氧原子,每一个氧原子跟两个碳原子相结合
6.下列各组物质中只用水就能鉴别的是
A、苯、乙酸、四氯化碳 B、乙醇、乙醛、乙酸
C、乙醛、乙二醇、硝基苯 D、苯酚、乙醇、甘油
7.下列反应的离子方程式正确的是
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2OFe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu===Fe2++Cu2+
8.已知下列热化学方程式:①Zn(s)+1/2O2(g)===ZnO(s);ΔH1 ②Hg (l)+1/2O2(g)===HgO(s);ΔH2,则Zn(s)+HgO(s)===Hg(l)+ZnO(s);ΔH3,ΔH3为
A.ΔH2-ΔH1 B.ΔH2+ΔH1
C.ΔH1-ΔH2 D.-ΔH1-ΔH2
9.某混合气体中可能含有H2 、CO、CO2 、HCl、NH3 和H2O (气)中的两种或多种,当混合气体依次通过:①澄清的石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓硫酸(无明显现象);④灼热的氧化铜(变红);⑤无水硫酸铜(变蓝)。对该混合气体成分的正确判断是
A.一定没有CO2 ,肯定有H2 B.一定有CO2 、CO和H2O (气)
C.可能有CO2 、NH3 和H2O (气) D.一定有H2 、CO2 和HCl
10.下列各组离子在溶液中能大量共存的是
A.Ca2+、HCO![]() 、Cl-、K+ B.Al3+、AlO
、Cl-、K+ B.Al3+、AlO![]() 、HCO
、HCO![]() 、Na+
、Na+
C.Fe2+、NH![]() 、SO
、SO![]() 、S2- D.Fe3+、SCN-、Na+、CO
、S2- D.Fe3+、SCN-、Na+、CO![]()
11.今有三个氧化还原反应:①2FeCl3+2KI===2FeCl2+I2+2KCl
②2FeCl2+Cl2===2FeCl3 ③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O。
若溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
12.已知强酸与强碱在稀溶液里反应的中和热可表示为:
H+(aq) + OH—(aq) == H2O(l);△H = -57.3KJ/mol
CH3COOH(aq) + NaOH(aq) == CH3COONa(aq) + H2O(l);△H = -Q1KJ/mol
1/2H2SO4(浓) + NaOH(aq) == 1/2Na2SO4(aq) + H2O(l);△H =-Q2KJ/mol
HNO3(aq) + NaOH(aq) == NaNO3(aq) + H2O(l);△H =-Q3KJ/mol
上述反应均系在溶液中进行的反应,Q1、Q2、Q3的关系正确的是:
A.Q1> Q2= Q3 B. Q2 > Q1 > Q3
C.Q2 >Q3 >Q1 D. Q2 = Q3 > Q1
13.共价键、离子键和范德华尔斯力是粒子之间的三种作用力。下列晶体①Na2O2 ②SiO2 ③石墨 ④金刚石 ⑤NaCl ⑥白磷中,含有两种作用力的是
A.①②③ B.①③⑥
C.②④⑥ D.①②③⑥
14.下图中验证氯化钠溶液(含酚酞)电解产物的装置是
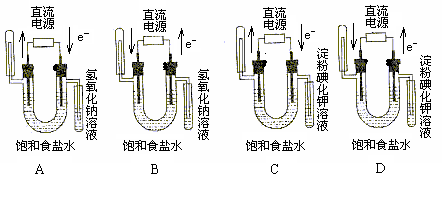 |
15.在吸收塔用98.3%的浓硫酸而不是用水吸收SO3的原因是
A.用水不能吸收SO3 B.用水吸收生成的酸雾多,影响吸收
C.用浓硫酸吸收不形成酸雾,吸收速率快 D.用浓硫酸吸收可以得到更浓的硫酸
16.某结晶水合物的分子式为R·nH2O其相对分子质量为M,在25℃时,a g该晶体溶于b g水中,即达到饱和,形成V mL密度为d g/cm3的溶液。下列表达式中正确的是
A.
该饱和溶液的物质的量浓度为![]()
B.25℃时,R的溶解度为![]()
C.该饱和溶液的物质的量浓度为![]()
D.该饱和溶液的质量分数为![]()
二、填空题:
17.(6分)在①渗析 ②盐析 ③聚沉 ④溶胶 ⑤凝胶 ⑥布朗运动 ⑦电泳 ⑧丁达尔效应 ⑨中和 ⑩水解 中选出适当的词语填入下列每小题的空格中(填编号)。
(1)在肥皂水中透过强光,从侧面可以见到光带。这种现象称为____________;
(2)在浓肥皂水中加入饱和食盐水(或固体食盐的细粒)使肥皂聚沉。这种现象称为______________________;
(3)热的浓肥皂水使之冷却并全部固化后的物质叫_________________;
(4)在肥皂水中加入酚酞变成红色,说明高级脂肪酸根离子发生了_________;
(5)在Fe(OH)3胶体中加入(NH4)2SO4,产生红褐色沉淀,这种现象叫做_________________;
(6)用半透膜把制取的Fe(OH)3胶体中含有的NaCl分离出去的方法叫做_______。
18.(5分)某化学反应的反应物和产物如下:
KMnO4+KI+H2SO4![]() MnSO4+I2+KIO3+K2SO4+H2O
MnSO4+I2+KIO3+K2SO4+H2O
(1)该反应的氧化剂是____________。
(2)如果该反应方程式中I2和KIO3的化学计量数都是5
①KMnO4的化学计量数是____________。
②在下面的化学式上标出电子转移的方向和数目
KMnO4+
KI+ H2SO4![]()
(3)如果没有对该方程式中的某些化学计量数作假定,可能的配平化学计量数有许多组,原因是____________________________________________________。
19.(5分)下图是以黄铁矿为开始反应物的一系列变化,其中不含硫的反应产物已略去。
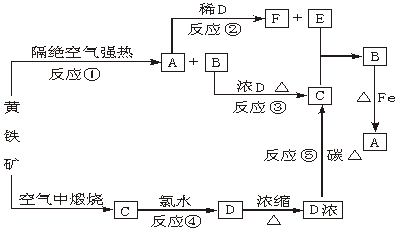
(1)写出化学式:A________。
(2)写出化学方程式:⑤___________________________________。
(3)写出离子方程式:②__________________________________。
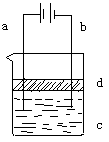 20.(9分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得白色、纯净的Fe(OH)2沉淀。可用如右下图所示电解实验来制得Fe(OH)2沉淀。两电极的材料分别为铁和石墨。
20.(9分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得白色、纯净的Fe(OH)2沉淀。可用如右下图所示电解实验来制得Fe(OH)2沉淀。两电极的材料分别为铁和石墨。
⑴ a电极材料应为_________,电极反应式为_____________。
⑵ 电解液c可以是___________(选填编号)
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
⑶ d是苯,其作用为__________________________,在加入苯之前应对c溶液进行如何处理?_______________________________。
⑷ 为了在较短时间内看到白色沉淀,可采取的措施是_____(选填编号)
A.改用稀硫酸做电解液 B.适当增加电源的电压
C.适当减小两电极间距离 D.适当降低电解液的温度
⑸ 若c用硫酸钠溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除在电极上可以看到气泡外,混合物中另一明显现象为________________________________________________________________。
三、实验题:
21.(5分)某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、______________、______________等玻璃仪器。
⑵步骤1过滤的目的是__________________________________________。
⑶当步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是______________。
⑷步骤2中溶液的pH控制较难操作,可改用____________________。
22.(12分)实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和Ca(OH)2制取少量漂白粉。现已知反应:2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O,该反应是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2===Ca(ClO3)2+5CaCl2+6H2O。现有三个同学分别设计的三套实验装置如下图:
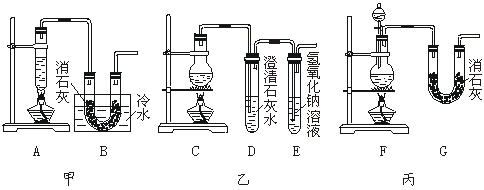 (1)写出制取氯气的化学方程式:_______________________________。
(1)写出制取氯气的化学方程式:_______________________________。
(2)请从以下几个方面对甲、乙、丙三套实验装置的优缺点作出评价,并将符合题目要求的选项的序号填在表中空格内。a 不容易控制反应速率 b.容易控制反应速率 c.有副反应发生 d.可防止副反应发生 e.污染环境 f.可防止污染环境
| 优点 | 缺点 | |
| 甲装置 | ||
| 乙装置 | ||
| 丙装置 |
(3)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成。请从上述装置中选取合理的部分,组装一套较完整的实验装置,装置各部分连接顺序是__________________。该组合中还缺少的装置是_________________________________________________________,原因是___________________________________________________________。
四、计算题:
23.把Cl2通入氨水中发生如下反应:3Cl2+8NH3![]() 6NH4Cl+N2↑,当逸出的气体中含有0.28 g N2时,反应中被氧化的氨的质量是________________
6NH4Cl+N2↑,当逸出的气体中含有0.28 g N2时,反应中被氧化的氨的质量是________________
24.某化工厂生产硫酸,使用一种含SiO2杂质的黄铁矿。经过测试该矿石,发现2.00 g矿石样品在氧气中充分灼烧,残余固体是1.60 g。已知SiO2在高温下不与氧气发生反应;黄铁矿与氧气反应的化学方程式为4FeS2+11O2![]() 2Fe2O3+8SO2;生产过程中,FeS2燃烧生成SO2时的转化率是92%,SO2催化氧化生成SO3时的转化率为86%,在吸收塔中SO3与水反应生成H2SO4时的转化率为94%。
2Fe2O3+8SO2;生产过程中,FeS2燃烧生成SO2时的转化率是92%,SO2催化氧化生成SO3时的转化率为86%,在吸收塔中SO3与水反应生成H2SO4时的转化率为94%。
(1)该矿石中FeS2的纯度是多少?
(2)由FeS2生成H2SO4的总转化率是多少?
(3)用1t这样的矿石可生产98%的浓硫酸多少吨?
参考答案
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 满分 | 48 | 25 | 17 | 10 | 100 |
| 实得分 |
一、选择题:(共3×16=48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | A | C | B | A | D | A | B | C | D | A | C | C | B | D | BC | BC |
二、填空题:(25分)
17.(6分)(1):⑧(1分)(2):②(1分) (3):⑤(1分)
(4):⑩(1分) (5):③(1分) (6):①(1分)
18.(5分)(1)KMnO4 (1分) (2)① 8 (1分)
![]() (2分)
(2分)
(3)该反应含两种氧化产物,两者的比例和氧化剂的用量都可以发生变化(1分)
![]() 19.(5分)(1)FeS (1分)
19.(5分)(1)FeS (1分)
(2)⑤C+2H2SO4(浓) CO2↑+2SO2↑+2H2O(2分)
(3)②FeS+2H+====Fe2++H2S↑(2分)
20.(9分) (1)Fe (1分);Fe-2e-=Fe2+ (1分) (2)BC (2分)
(3)隔绝空气、防止氧化(1分);加热煮沸赶走其中的空气 (1分) (4)B![]()
 C (2分)
C (2分)
(5)白色Fe(OH)2迅速变成灰绿色,颜色逐渐加深,最后变成红褐色. (1分)
三、实验题:(共17分)
21.(每空各1分共5分)⑴烧杯 漏斗 ⑵除去铁等不溶于碱的杂质;⑶取上层清液,逐滴加入稀硫酸,若变浑浊则说明沉淀不完全;若不变浑浊则说明沉淀完全;⑷通入足量的CO2气体
22.(共12分) (1)MnO2+4HCl![]() MnCl2+Cl2↑+2H2O (2分) (2)(6分)
MnCl2+Cl2↑+2H2O (2分) (2)(6分)
| 优点 | 缺点 | |
| 甲装置 | d | a、e |
| 乙装置 | f | a、c |
| 丙装置 | b | c、e |
(3)FBE (2分) 盛饱和食盐水的洗气瓶 (1分) 除去Cl2中混有的HCl (1分)
四、计算题:(10分)
23.答案:0.34 g (2分)
24.答案:(1)60% (2分) (2)74% (3分) (3)0.74 t (3分)