高三化学第一次模拟测试卷
化 学 试 题
考生须知:1.本卷满分100分,考试时间100分钟。
2.答题前,请在答题卡密封区内填写学校、姓名、学生序号。
3.所有答案必须写在答题卡上,考试结束后,只需上交答题卡。
可能用到的相对原子质量:H~1,C~12,N~14,O~16,Na~23,Mg~24,Al~27,
Cl~35.5,Fe~56
第Ⅰ卷(选择题,共50分)
选择题:(本大题包括16小题,每小题3分共48分,每小题只有一个正确选项)
1.2007年9月,美国科学家宣称发现了普通盐水在无线电波照射下可燃烧,这很可能是21世纪人类最伟大的发现之一,有望解决用水作人类能源的重大问题。无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧。上述中“结合力”实质是 ( )
A.分子间作用力 B.氢键 B.非极性共价键 D.极性共价键
2.下列说法正确的是 ( )
A.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
B.液氨、石墨和水分别属于非电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D.纯碱、硝酸、硬脂酸钠和干冰分别属于碱、酸、盐和氧化物
3.下列各组物质中,前一种与后二种物质反应后不能产生同一种气体的是 ( )
A.Al、NaOH溶液、盐酸 B.(NH4)2S、NaOH溶液、盐酸
C.H2O、Na2O2、F2 D.NaHCO3、NaHSO4溶液、盐酸
4.下列说法中正确的是 ( )
①电解是将电能转化为化学能;②电解是将化学能转变成电能;③电解质溶液导电是化学变化,金属导电是物理变化;④不能自发进行的氧化还原反应可通过电解的原理实现;⑤任何物质被电解时,必导致氧化还原反应发生;
A.①③④⑤ B.②③⑤ C.③④ D.①②③④
5.过氧化氢俗称双氧水,为一种易分解无色液体,常作氧化剂、漂白剂和消毒剂。为贮存、运输、使用方便,工业上将H2O2转化为固体的过碳酸钠(化学蚀为:2Na2CO3·3H2O2),
该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使通过碳酸晶体失效变质的是
( )
A.K2S B.NaHCO3 C.稀HCl D.MnO2
6.下列各组物质比较中,不正确的是 ( )
A.单质的熔点:Li>Na>k,Na<Mg<Al
B.氢化合物的沸点:H2O>H2S,HF>HBr
C.分子的稳定性:HF<H2O<NH3,O2>N2
D.离子半径:N3->Na+>Mg2+,S2->O2-
7.设NA为阿伏枷德罗常数的值,下列叙述正确的是 ( )
A.常温常压下,11.2L的甲烷气体中含甲烷分子数为0.5NA
B.0.5L 1mol·L-1的NH4CL溶液中含NH4+数为0.5NA
C.2.8g铁粉与硝酸反应失去的电子数一定为0.15NA
D.14g乙烯和丙稀的混合物中原子总数为3NA
8.亚硝酸钠(NaNO2)具有导癌作用,许多腌制食品中含NaNO2。酸性KMnO4溶液与亚硝酸钠反映的离子反应为:MnO4- + NO2- +H+ ===== Mn2+ + NO3-+H2O(未配平),下列叙述错误的是 ( )
A.成1molMn2+,转移电子为5mol
B.该反应中氮元素被氧化
C.配平后,水的化学计量数为3
D.反应中氧化物与还原产物的物质的量之比为2∶5
9.下列关于反映能量的说法正确的是 ( )
A.CaCO3(s)======CaO(s)+CO2(g);△H = +178.5kJ·mol-1,反应物总能量大于生成物总能量
B.Zn(s)+CuSO4(aq)======ZnSO4(aq)+Cu(s);△H = -206kJ·mol-1,反应物的总能量大于生成物的总能量
C.H+(aq)+ OH-(aq)======H2O(![]() );△H = -57.3kJ·mol-1,含1mlNaOH的稀溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
);△H = -57.3kJ·mol-1,含1mlNaOH的稀溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
D.101Kpa时,2H2(g)+O2(g)
======2H2O(![]() );
);
△H = -571.6J·mol-1,H2的燃烧热为571.6kJ·mol-1
|
A.少量的苛性钠溶液加入到Ca(HCO3)2溶液中:
Ca2+ +2HCO3 +2OH- ======CaCO3+COCO32- +2H2O
B.用氨水吸收过量二氧化硫:NH3·H2O+SO2======NH4+ + HSO3-
C.金属钠加入硫酸铜溶液:2Na+Cu2+ +2H2O=====Cu(OH)2↓+ 2Na+ +H2↑
D.过量的铁加入一定量的稀硝酸中:3Fe+8H+ +2NO3 -=====3Fe2++2NO↑+4H2O
11.目前人类已发现的非金属元素除稀有气体外,共有16种,下列对这16种非金属元素的相关判断: ( )
①都是主族元素,原子的最外层电子数都大于4
②单质在反应中都只能做氧化剂
③氢化物常温下都是气态,所以都叫气态氢化物
④氧化物常温下都可以与水反映生成酸
A.有①②正确 B.只有①③正确 C.只有③④正确 D.①②③④均不正确
|
集的气体是 ( )
①锌和稀硫酸制氢气②双氧水和二氧化锰制氧气
③浓氨水和生石灰制氨气④铜和稀NHO3制NO
⑤MnO2和浓盐酸制氯气⑥乙醇和浓H2SO4制乙烯
A.①②③ B.④⑤⑥
C.② D.④⑥
13.常温下,按下列操作进行实验,所得溶液的pH一定等于7的是 ( )
A.将1mLpH=5的稀盐酸加水稀释到100mL
B.0.1mol·L-1的某二元酸和0.1mol·L-1的某二元强碱等体积混合
C.pH=2的某一元酸和 pH=12的某一元碱等体积混合
D.pH=2的某二元强酸和pH=12的某一元强碱等体积混合
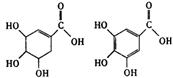
|
A.两种酸都能和溴水反应
B.两种酸遇三氯化铁溶液都显紫色
C.鞣酸分子与莽草酸分子相比多两个碳碳双键
D.等物质的量的两种酸与NaOH反应,消耗NaOH的量相同
15.某共价化合物含碳、氢、氮三种元素,分子中共有四个氮原子,且都位于正四面体的顶点,每两个氮原子间都有一个碳原子。已知分子内无碳碳单键,也没有碳碳双键,则该化合物的分子式为 ( )
A.CH8N4 B.C4H8N4 C.C6H10N4 D.C6H12N4
|
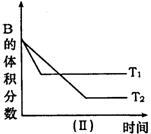
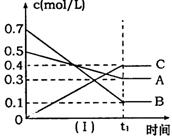
|
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
C.![]() 时,在相同容器中,若由0.4mol/L A、0.4mol/L B和0.2mol/L C反应,达到平衡后,C的浓度也为0.4 mol/L
时,在相同容器中,若由0.4mol/L A、0.4mol/L B和0.2mol/L C反应,达到平衡后,C的浓度也为0.4 mol/L
D.(t1+10)min时,保持压强不变,通入稀有气体,平衡不移动
|
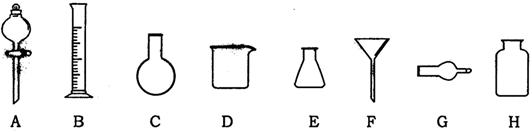
17.下列是中学化学实验中常见的实验仪器。
|
(1)下列实验中,上述仪器被正确选用的是 ;
①用B量取8.80mL稀硫酸
②乙酸乙酯与饱和Na2CO3溶液的分离常用A
③干燥氨气需用G或H
④石油的分馏需用C
⑤粗盐提纯需用F和D
(2)下列有关实验叙述,不正确的是 ;
①铜片和稀硝酸反应产生的气体只能用排水法收集
②用碱式滴定管盛装酸性KMnO4溶液滴定KI溶液
③蒸干、灼烧CuSO4溶液得到无水硫酸铜
④制备Fe(OH)3胶体,将饱和FeCl3溶液加入到沸水中,不断加热
⑤实验室制取乙烯,温度计插入反应物溶液中
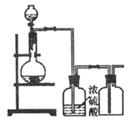
18.(7分)某课外研究小组,用含有较多杂质的铜粉制取胆固。其设计的实验过程如下;
 |
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于
上,(填写下列仪器编号,下同),取用坩埚应使用 ,灼烧后的坩埚应放在
上。
A.蒸发皿 B.石棉网 C.泥三角 D.表面皿
E.坩埚钳 F.试管夹
(2)同粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热、同氧气、过滤、
、冷却结晶、 、洗涤、自然干燥。
(3)在测定所得胆矾[CuSO4·xH2O]中结晶水x值的实验过程中,称量操作至少进行 次
19.(8分)W、X、Y、Z、A、B是原子序数依次增大的六种常见元素。A的单质在Y2中燃烧的产物可使品红溶液褪色。B和Y元素形成的化合物B3Y4具有磁性。W的单质在Y2中燃烧可生成WY和WY2两种气体。Z的单质是一种金属,该金属在WY2中剧烈燃烧生成黑、白两种固体。
(1)X的单质分子的电子式为 ;B元素的在周期表中的位置是 ;
(2)Z在WY2中燃烧的化学方程式 ,W、X、Y分别与氢形成的10电子氢化合物中,沸点最低的是(写化学式) ;
(3)AY2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体XY有关的离子方程式为 ,有此可见XY和AY2相比还原性较强的是(写化学式) 。
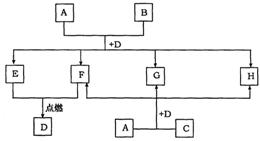
20.(9分)下图中所有物质均由短周期元素组成,A的焰色反应为黄色,B、C、G均含同一种元素,D常温下为液体,B、C均溶于H的溶液。
|
请回答:
(1)若B为金属,化学式为 ,工业上由C制取B的化学方程式为
;
(2)若B为非金属,化学式为 ,工业上由C制取B的化学方程式为
;
(3)若B为非金属,写出A+B+D→E+F+G+H的离子方程式(其中E和F的物质的量之比为3∶1): 。
|
 |
①正四面体烷 , ②乙烯基乙炔CH2=CH-C=CH,③苯
(1)正四面体烷的分子式为 ;
(2)关于乙烯基乙炔的说法错误的是 ;
A.能使酸性KMnO4溶液褪色
B.等质量的乙炔和乙烯基乙炔完全燃烧时的耗氧量不相同
C.1mol 乙烯基乙炔能与3mol Br2 发生加成反应
D.乙烯基乙炔分子内含有两种官能团
(3)写出与苯互为同系物且一氯化物只有两种物质的结构简式:(写两个) 。
22.(8分)奶油中有一种只含C、H、O的化合物A。A可以用作香料,其相对分子质量为88,分子中C、H、O原子个数比为2∶4∶1,且含有碳氧双键。
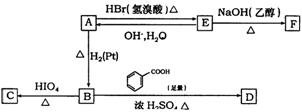
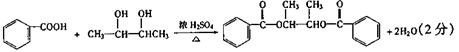
![]()
![]() 已知:①ROH+HBr(氢溴酸) RBr+H2O ②RCH—CHR′ RCHO+R′CHO
已知:①ROH+HBr(氢溴酸) RBr+H2O ②RCH—CHR′ RCHO+R′CHO
|
(1)写出下列反应化学方程式和反应类型:
①E→F ;反应类型为 ;
②B→D ;反应类型为 ;
(2)在空气中长时间搅拌奶油,A可以转化为相对分子质量为86的化合物G,G的一氯代物只有一种,写出G的结构简式 。
23.(6分)银锌碱性蓄电池是一种可以反复充电、放电的装置。电池反应是:
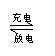 |
2Ag+Zn(OH)2 Zn+Ag2O+H2O
假如此种蓄电池分别用来电解下列两种溶液,工作一段时间后蓄电池都分别消耗0.72gH2O(电解池的电极均为惰性电极)。回答:
(1)电解M(NO3)x溶液时,某一极增加了agM,则金属M的相对原子质量为
(用a、x表示);
(2)电解含有0.04mloCuSO4和0.04molNaCl的混合溶液400ml,则阳极产生的气体是
升(标准状况);此时溶液的pH = (假设电解后溶液体积不变)
参 考 答 案
第I卷 选择题(48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | A | B | A | B | C | D | D | B | A | D | C | D | A | D | C |
|
17.(6分)(1)②⑤(3分) (2)②④(3分)
|
|
|
(2)2Mg + CO2 ====== MgO + C(2分) CH4(1分)
|
|
(2)Si(1分) SiO2+2C=====Si+2CO↑(2分)
(3)2Na2O2+2Al+4H2O=====4Na+ +2AlO2- +O2↑+3H2↑+2OH-
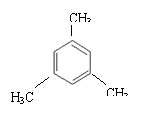
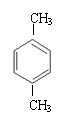 21.(8分)(1)C4H4(2分) (2)B(2分)
21.(8分)(1)C4H4(2分) (2)B(2分)
(2分) (2分)
![]() 22.(8分)(1)①CH3—C—CH+CH3 + NaOH CH3—C—CH = CH2+NaBr + H2O(2分)
22.(8分)(1)①CH3—C—CH+CH3 + NaOH CH3—C—CH = CH2+NaBr + H2O(2分)
|
②2
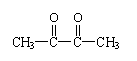 酶化反应(1分)
酶化反应(1分)
(2) (2分)
23.(6分)(1)12.5ax (2)0.672 1 (每空2分)