高三化学金属单元测试试卷
可能用到的原子量:H:1 Li:7 C:12 O:16 Na:23 Mg:24 Al:27 Fe:56 Cu:64
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意)
1、下列有关金属铷的说法,正确的是( )
A.铷是活泼金属,将铷投入FeSO4溶液中,可将铁置换出来
B.铷在化学反应中,易失电子,表现出氧化性
C.铷是一种比水重的金属
D.铷着火时,应用泡沫灭火器灭火
2、16.8gNaHCO3和7.8gNa2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为
500℃,最后容器内物质是( )
A.Na2CO3,Na2O,O2 B.Na2CO3,O2,H2O(g)
C.Na2CO3,CO2,O2,H2O(g) D.NaHCO3,Na2CO3,O2
3、下列各组离子在水溶液中不能大量共存的是( )
A、AlO2-、Na+、CO32-、OH- B、K+、H+、NO3-、SO42-
C、Na+、HCO3-、Cl-、AlO2- D、SiO32-、Na+、SO42-、S2-
4、由两种金属组成的合金10g,投入足量的稀HCl中,完全反应后产生的氢气在标况下的体积为11.2L,则合金不可能是( )
A、镁、铜合金 B、锂、镁合金 C、铁、铝合金 D、铜、锂合金
5. 铊(Tl)是超导材料的重要元素之一。它位于第六周期,与地壳中含量最多的金属元素同族。对于铊的性质有以下判断,其中不正确的是( )
A.铊是银白色金属,易导电
B.铊具有强还原性,容易与O2反应
C.+5价铊的化合物为共价化合物,+3价铊的化合物可能是离子化合物
D.Tl(OH)3碱性比Al(OH)3强
6. 下列物质充分反应后,滴入KSCN溶液,显红色的是( )
A.FeO与稀HNO3 B.过量Fe与稀HNO3
C.FeO与稀盐酸 D.Fe与CuSO4溶液
7. 某溶液中含有较多的AlO2-,则溶液中可能存在的离子组合是( )
A. Al3+、NO3-、SO42- B.Mg2+、SO42-、Cl-
C. H+、NH4+、Cl- D. Na+、Cl-、OH-
8. 下列各种情况下,能大量共存于同一溶液中的离子组是 ( )
A.pH=0的溶液:Fe2+、Br—、Na+、NO3—
B. C(H+)=1.0 ×10—12mol· L—1的溶液中:K+ 、AlO2—、 NO3— 、 Na+
C. 酸性溶液中:Fe3+ 、 K+ 、 SCN— 、 SO42—
D. 石蕊试液呈紫色的溶液中:NH4+、 Al3+、NO3— 、 HCO3—
9.为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是( )
A、NaOH溶液(Ba(OH)2溶液) B、FeSO4溶液(KSCN溶液)
C、KI(淀粉溶液) D、Na2SO3溶液(BaCl2溶液)
10.下列说法不正确的有( )
①用稀盐酸清洗做焰色反应的铂丝;②医疗上可用碳酸钡作X射线透视肠胃的内服药;③水玻璃在建筑业上用做粘合剂;④铝和铜具有良好的导电性,所以电工操作时,可把铜线和铝线绞接在一起;⑤氯化铵可用于金属的焊接上,以除去金属表面上的氧化物薄层;⑥医用酒精的质量分数为85%;⑦用新制备的Cu(OH)2悬浊液与病人尿液共热,可检验病人尿中是否含有葡萄糖
A、1个 B、2个 C、3个 D、4个
11.在实验中不慎将手指被玻璃划破,可用氯化铁溶液应急止血,其主要原因是( )
A、 FeCl3溶液具有杀菌消毒作用 B、FeCl3溶液能产生Fe(OH)3胶体堵住伤口
C、含有的铁元素对人体有益 D、FeCl3溶液能使血液聚沉
12.工业上冶炼金属一般用热分解法、热还原法和电解法。不同的金属应选用不同的冶炼方法。你认为选择的原则主要是依据( )
A、金属在自然界的存在形式 B、金属熔点的高低
C、金属离子得电子的能力 D、金属元素在地壳中的含量
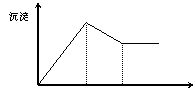 13. 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入
13. 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入
NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如
图所示,则溶液中C(Cl¯)与C(SO42-)之比为( )
A、1∶1 B、2∶3
C、3∶2 D、2∶1
14. 以下各组均有三种溶液,这三种溶液中所含溶质的物质的量均相等,将它们充分混合后,不会产生沉淀的是( )
A.AlCl3、Ba(OH)2、HCl B.MgCl2、Na2CO3、HCl
C.MgCl2、Ca(OH)2、HNO3 D.NaAlO2、NaOH、H2SO4
15. 某稀硝酸能与4.8 gCu恰好完全反应,等量的此稀硝酸在和Fe反应同样生成NO时,最多消耗Fe为( )
A. 2.8 g B. 4.2 g C. 4.8 g D. 5.6 g
16. 把金属铁、铜置于氯化铁溶液中充分反应后,下列情况不能成立的是( )
A、铁、铜都剩余,溶液中有Fe2+
B、铁、铜都不剩余,溶液中可能有Fe3+,一定有Fe2+和Cu2+
C、铁剩余、铜不剩余,溶液中一定有Fe2+
D、铁不剩余、铜剩余,溶液中一定有Fe2+
 二、填空题(共52分)
二、填空题(共52分)
17、某中学某研究性学习小组在施老师指导下做了一个如右图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。
(1)请根据所学知识,做出合理和大胆的预测,其原因可能是 。
(2)题中后一种情况溶液显红色的原因是(用离子方程式表示) 。
18. 等质量的锌、铁、铜三种金属混合物a g加入到FeCl3和盐酸的混合液中,充分反应后:
(1)若无固体剩余,则溶液中的阳离子一定有 ,可能有 ;
(2)若剩余固体为(a/3)g,则溶液中的阳离子一定有 ,可能有 ,一定没有 ;
(3)若剩余固体为(3a/4)g ,则溶液中的阳离子一定有 。
19. 元素X的单质及X与Y形成的化合物能按如
![]() 右图所示的关系发生转化:(m不等于n)
右图所示的关系发生转化:(m不等于n)
(1)若X为金属,则X为 ;n= 。
(2)若X为非金属,则X为 ;置换反应方程式为 。
20. .过氧化钠能在潜水艇中作供氧剂,供人类呼吸之用。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,设计出如右实验装置:
(1)过氧化钠在潜水艇中作供氧剂的主要反应原理是(用化学方程式表示) ;B装置的作用是吸收A装置中产生的盐酸酸雾,C装置的现象是 。
(2)为了检验E中收集到的气体,E中收集满气体后,下一步实验操作是
。
(3)E装置是否安全、合理? ;E是否需要改进,若需要改进,应改为下图中的 。
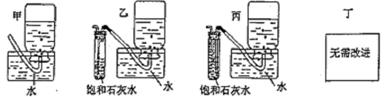 |
(4)装置的气密性良好的情况下,反应完毕时,若测得E中的集气瓶收集到的气体为250毫升,比理论计算值 (填“大”或“小”),分析其可能的原因是
。
21.(12分)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20gA全部溶于0.15L 6.0mol·L-1的盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。请填空:
(1)①中引发铝热反应的实验操作是__________________,产物中的单质是____________。
(2)②中所发生的各反应的化学方程式是_______________________________________。
(3)③中所发生的各反应的离子方程式是______________________________________。
(4)若溶液D的体积仍视为0.15L,则该溶液中C(Mg2+)为_____________, C(Fe2+)为_____________。
高三化学试卷 —— 金属答案 (2008、2、22)
1-5 CBCAC 6-10 ACBDA 11-16DCBBC
17.(6分) (1)(2分)氢气在此条件下生成了双氧水。
(2)(4分)2Fe2++H2O2+2H+=2Fe3++2H2O;Fe3++3SCN-=Fe(SCN)3。
18.(12分) (1) Zn2+ 、Fe2+、Cu2+、H+; Fe3+
(2) Fe2+、Zn2+; H+; Cu2+、Fe3+ (3) Zn2+; (每空2分)
19.(8分) (1)(4分)Fe;3。
(2)(4分)C;2C+SiO2===Si+2CO↑(反应条件为“高温”)。
20.(12分) (1)2Na2O2+2CO2=2Na2CO3+ O2↑;(2分) 白色固体变蓝色;(1分)
(2)取出集气瓶,用带火星的木条伸入集气瓶内,如果木条复燃,说明过氧化钠与二氧化碳反应产生氧气,可做供氧剂。;(2分)
(3)不安全,不合理;(2分) 乙。 (1分)
(4)小;(2分) Na2O2可能含有其它杂质;D装置可能有氧气未被排出。(2分)
21.(14分) (1)在铝热剂上铺一层氯酸钾,插上镁条,点燃镁条, Fe。(2分)
(2)MgO+2HCl==MgCl2+H2O, (2分)Fe2O3+6HCl==2FeCl3+3H2O。(2分)
(3)Fe+2Fe3+==3Fe2+,(2分)Fe+2H+==Fe2++H2↑。(2分)
(4)0.67mol•L-1;(2分)2.33 mol•L-1。(2分)