厦门市教科院化学科新课程《化学反应原理》评价参考试题
专题一《化学反应与能量变化》专题检测试卷
相对原子质量:H1 C12 N 14 O 16 S32 Cl35.5 Zn 65 Na 23 Mg 24
Al 27 Cu 64 Ag 108 Hg 201
第Ⅰ卷(共54分)
一、选择题(共27小题,每题只有一个正确的答案,每题2分,共54分。)
1、.(2007年高考理综上海卷)氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括( )
①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
(A)①② (B)①③ (C)③④ (D)②④
2、下列反应属于吸热反应的是 ( )
A.炭燃烧生成一氧化碳 B.中和反应
C.锌粒与稀H2SO4反应制取H2 D.Ba(OH)2·8H2O与NH4Cl反应
3、已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A、H2O(g)=H2(g)+![]() O2(g);
O2(g);![]() H=
+242kJ·mol-1
H=
+242kJ·mol-1
B、2H2(g)+O2(g) = 2H2O(l);![]() H=
-484kJ·mol-1
H=
-484kJ·mol-1
C、H2(g)+![]() O2(g)=H2O(g);
O2(g)=H2O(g);![]() H=
+242kJ·mol-1
H=
+242kJ·mol-1
D、2H2(g)+O2(g)=2H2O(g);![]() H=+
484kJ·mol-1
H=+
484kJ·mol-1
4、(06天津理综)已知反应:
①101kPa时,2C(s)+O2(g)=2CO(g);ΔH=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3kJ/mol
下列结论正确的是
A.碳的燃烧热大于110.5kJ/mol B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
5、银锌钮扣电池的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH- ;总反应为:Ag2O+Zn=2Ag+ZnO,下列判断正确的是( )
A、锌为正极,Ag2O为负极; B、锌为阳极,Ag2O为阴极;
C、原电池工作时,负极区PH减小; D、原电池工作时,负极区PH增大;
6、有关原电池的工作原理中的下列说法中不正确的是 ( )
A.电池负极发生氧化反应 B.电池正极发生还原反应
C.电子流向是从负极流向正极(外电路) D.电流方向是从负极流向正极(外电路)
7、随着人们生活质量的不断提高,废电池必须集中处理的问题被提到议事日程,首要原
因是
A、利用电池外壳的金属材料
B、防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C、不使电池中渗泄的电解液腐蚀其他物品
D、回收其中石墨电极
8、下列叙述正确的是( )
A.原电池中阳离子向负极移动 B.用铝质铆钉铆接铁板,铁易被腐蚀
C.马口铁(镀锡)的表面一旦破损,铁腐蚀加快 D.白铁(镀锌)的表面一旦破损,铁腐蚀加快
9、在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用( )
A.NaOH B.HC1 C.NaCl D.CuSO4
10、下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ( ) 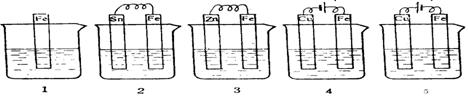
A、 4>2>1>3>5 B、 2>1>5>3>4
C、 5>4>2>3>1 D、 3>5>2>4>1
11、.已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:
N2 + 3H2 = 2NH3 ΔH=—92.4 KJ/mol,则N≡N键的键能是 ( )
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
12、(2007年高考上海化学卷)已知:
CH3CH2CH2CH3(g)+6.5O2(g)![]() 4CO2(g)+5H2O(l);DH =-2878 kJ
4CO2(g)+5H2O(l);DH =-2878 kJ
(CH3)2CHCH3(g)+6.5O2(g)![]() 4CO2(g)+5H2O(l);DH =-2869 kJ
4CO2(g)+5H2O(l);DH =-2869 kJ
下列说法正确的是( )
(A)正丁烷分子储存的能量大于异丁烷分子
(B)正丁烷的稳定性大于异丁烷
(C)异丁烷转化为正丁烷的过程是一个放热过程
(D)异丁烷分子中的碳氢键比正丁烷的多
13、(05全国卷I).已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则
乙炔燃烧的热化学方程式正确的是
A.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l);△H = -4b KJ/mol
B.C2H2(g) + 5/2O2(g) == 2CO2(g) + H2O(l);△H = 2b KJ/mol
C.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l);△H = -2b KJ/mol
D.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l);△H = b KJ/mol
14、已知2H2(g)+ O2(g)=2H2O(g) △H= ─484KJ/moL,则反应: H2O(g)= H2(g)+1/2O2(g) 的△H为 ( )
A、─484KJ/moL B、+484KJ/moL C、─242KJ/moL D、+242KJ/moL、
15、已知下列热化学方程式:Zn(s)+1/2O2(g)=ZnO(s)ΔH1 =—351.1 kJ/mol
Hg(l)+1/2O2(g)=HgO(s) ΔH2 =—90.7 kJ/mol 。由此可知Zn(s)+HgO(s)ZnO(s)+Hg(l)△H3。其中△H3的值是 ( )
A、 —441.8kJ/mol B、—254.6kJ/mol C、—438.9kJ/mol D、—260.4kJ/mol
16.(2007年高考广东化学卷)灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g);DH1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g);DH2
③Sn(s、灰)![]() Sn(s、白);DH3=+2.1 kJ/mol
Sn(s、白);DH3=+2.1 kJ/mol
下列说法正确的是( )
(A)DH1>DH2 (B)锡在常温下以灰锡状态存在
(C)灰锡转化为白锡的反应是放热反应
(D)锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
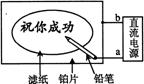 17.(07上海)某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
17.(07上海)某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
A 铅笔端作阳极,发生还原反应 B、铂片端作阴极,发生氧化反应
C 铅笔端有少量的氯气产生 D a点是负极,b点是正极
18.家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此过程中不发生反应( )
A.4Fe(OH)2+2H2O+O2===4Fe(OH)3 B.2Fe+2H2O+O2===2Fe(OH)2
C.2H2O+O2+4e-===4OH- D.Fe-3e-===Fe3+
19.下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
20.下列各变化中属于原电池的反应的是( )
A、在空气中金属铝表面迅速氧化形成保护层
B、镀锌铁表面锌有划损时,也能阻止铁被氧化
C、红热的铁丝与冷水接触,表面表成蓝黑色保护层
D、锌和稀硫酸反应时,用锌粉比等质量的锌粒可使反应加快
21.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是( )
A.CuCl2 [CuSO4] B.NaOH [NaOH] C.NaCl [HCl] D.CuSO4 [Cu(OH)2]
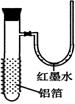 22.(07上海).用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是
22.(07上海).用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是
A 实验中发生的反应都是氧化还原反应
B 铝是一种较活泼的金属,
C 铝与氧气反应放出大量的热量
D 铝片上生成的白毛是氧化铝和氧化汞的混合物
23、.用铂电极电解CuSO4和KNO3的混合液500mL,经过一段时间后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为( )
A.0.5mol·L-1 B.0.8mol·L-1 C.1.0mol·L-1 D.1.5mol·L-1
24.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是( )
A.在熔融电解质中,O2-由负极移向正极
B.通入丁烷的一极是正极,电极反应为:2C4H10+26e-+13O2-=4CO2+5H2O
C.通入空气的一极是负极,电极反应为:O2+4e-=2O2-
D.电池的总反应是:2C4H10+13O2 ® 8CO2+10H2O
25
|
A.A池为电解池,B池为原电池
B.D、E两极都发生氧化反应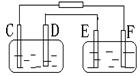
C.E极应为粗铜板材料
|
26.某同学为了使反应2HCl
+ 2Ag![]() 2AgCl
+ H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是( )
2AgCl
+ H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是( )
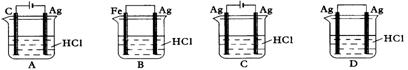
27.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A. 阳极发生还原反应,其电极反应式:Ni2++2e- =Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 电解后,电解槽底部的阳极泥中只有Cu和Pt
班级 学号 姓名
一、选择题 (每小题只有一个选项符合题意,每小题2分,共54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 |
| 答案 |
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共46分)
三、填空题
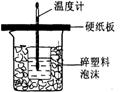 28.(7分)中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
28.(7分)中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间填满碎塑料泡沫的作用是______________ ___________________。
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小’、“无影响”)
(3) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,
与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是____________
___________________________________;所求中和热的数值会________(填“相等”
或“不相等”),理由是__________________________________________________。
29、(7分)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳。然后是使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的化学方程式为:
a.C(s)+ O2(g) = CO2(g) △H=E1 ①
b.C(s) + H2O(g) = CO(g)+ H2(g) △H=E2 ②
H2(g)+ 1/2 O2(g) = H2O(g) △H=E3 ③
CO(g)+ 1/2 O2(g) = CO2(g) △H=E4 ④
回答:
⑴与途径a相比途径b有较多的优点,即______ _________.
⑵上述四个热化学方程式中哪个反应△H >0?________________
⑶等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是( )
A、a比b多 B、a比b少 C、a与b在理论上相同
⑷根据能量守恒定律,E1、E2、E3、E4之间的关系为____________
30、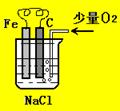 (6分)分析右图,按要求写出有关反应方程式:
(6分)分析右图,按要求写出有关反应方程式:
(1)、铁棒上的电极反应式为: ;
(2)、碳棒上的电极反应式为: ;
(3)、溶液中发生反应的化学方程: 。
31.(10分)按要求对下图中两极进行必要的联接并填空:
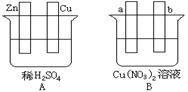
(1)在A图中,使铜片上冒H2气泡。请加以必要联接,则联接后的装置叫 。电极反应式:锌板: ;铜板: 。
(2)在B图中,使a极析出铜,则b析出: 。加以必要的联接后,该装置叫
。电极反应式,a极: b极: 。经过一段时间后,停止反应并搅均溶液,溶液的pH值 (升高、降低、不变),加入一定量的 后,溶液能恢复至与电解前完全一致。
32.(4分)采用惰性电极从![]() 选出适当离子组成的电解质(非熔融态下),并电解,
选出适当离子组成的电解质(非熔融态下),并电解,
(1)若两极分别放出![]() 和
和![]() ,电解质可能为
。(2)若阴极析出金属,阳极放出
,电解质可能为
。(2)若阴极析出金属,阳极放出![]() ,电解质可能为
。(3)若两极分别放出气体,且体积比为
,电解质可能为
。(3)若两极分别放出气体,且体积比为![]() ,电解质可能为
。(4)若既无
,电解质可能为
。(4)若既无![]() 也无
也无![]() 放出,则电解质可能为
。
放出,则电解质可能为
。
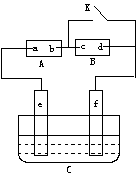 33.(6分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
33.(6分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为______________极
(2)滤纸B上发生的总化学方程式为:
________________________________
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为:_________________________ ,电极f上发生的反应为:_____________________,槽中盛放的镀液可以是____________溶液。
四、计算题:(6分)
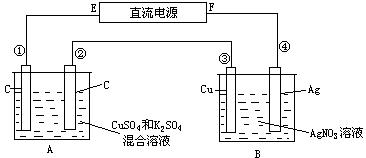
34.如图所示,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为200 mL,求通电前A池中原混合溶液Cu2+的浓度。
厦门市教科院化学科新课程《化学反应原理》评价参考试题
专题一《化学反应与能量变化》试题参考答案
禾山中学:连国东
参考答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | A | D | A | A | C | D | B | C | A |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | A | B | A | A | D | D | D | D | D |
| 题号 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 |
| 答案 | C | B | C | D | C | D | D | C | D |
28、(7分)(1)环形玻璃搅拌棒;(1分)保温、隔热,减少实验过程中的热最损失(1分)
(2)偏小(1分)
(3)不相等;(1分)因为酸、碱发生中和反应放出的热量与酸、碱的用量有关(1分); 相等(1分);中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量,它与酸、碱的用量无关(1分)
29、(7分)(1)固体煤经处理变成气体燃料后,不仅可以大大减少SO2和烟尘对空气造成的污染,而且燃烧效率高,也便于运输。 (2)② (3)C (4)E1=E2+E3+E4
30、(6分)(1)、Fe - 2e- = Fe2+ (2)、2H2O + O2 + 4e- = 4OH-
(3)、2Fe+2H2O+O2= 2 Fe(OH) 2 4Fe(OH) 2+2H2O+O2=4Fe(OH) 3
31、(10分)联接画线略。(1)原电池 ,锌板:Zn-2e- =Zn2+ 铜板:2H2+ +2e-=H2↑
(2)O2,电解池,a极:Cu2++2e- =Cu,b极:4OH――4e-=O2↑+2H2O,降低,CuO(每空1分,连线1分)
32、(4分)(1)Ba(NO3)2、H2SO4、HNO3 (2)AgNO3、Cu(NO3)2、CuSO4 (3)HCl、BaCl2 (4)CuCl2
![]() 33、(6分)(1)正极、(2)2NaCl + 2H2O===2NaOH+H2↑+Cl2↑ (3)Zn-2e- =Zn2+,Zn2++2e-=Zn,ZnCl2(ZnSO4)(除(2)方程式2分外,余空均赋1分,最后一空写一个答案即可)
33、(6分)(1)正极、(2)2NaCl + 2H2O===2NaOH+H2↑+Cl2↑ (3)Zn-2e- =Zn2+,Zn2++2e-=Zn,ZnCl2(ZnSO4)(除(2)方程式2分外,余空均赋1分,最后一空写一个答案即可)
34.(6分)解:在A池中发生的反应为:
阳极(②极):4OH-- 4e-=2H2O+O2↑
阴极(①极):2Cu2++4e-=2Cu
若Cu2+完全放电后还有:4H++4e-=2H2↑ 转移电子的物质的量为:2.16÷108=0.02(mol)
由电极反应可知,每转移4mol电子,放出1molO2,所以②极上析出O2的体积为: 0.02÷4×22.4=0.112(L)<0.224(L)
说明A池收集到的气体中还有H2。①极上放出H2为:0.224-0.112=0.112(L),即0.005mol。
①极上析出Cu和放出H2共获得0.02mol电子。
Cu2+的物质的量为:(0.02-0.005×2)/2=0.005(mol)[Cu2+]=0.005/0.2=0.025(mol/L) 答:通电前A池中原混合溶液Cu2+的浓度为0.025mol/L。