高三化学复习班反应与能量变化检测题
选修四第一章化学反应与能量变化
第Ⅰ卷 选择题 (共44 分)
一、选择题(本题包括个11小题,每小题只有一个选项符合题意,每小题4分,共44分,把答案填入答案卡中)。
1、未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦
2、下列过程中,需要吸收能量的是( )
A. H+H=H2 B. H+Cl=HCl C. I2→I+I D. S+O2=SO2
3、下图是101kPa时氢气在氯气中点燃生成氯化氢的能量变化示意图,则下列说法不正确的是( )
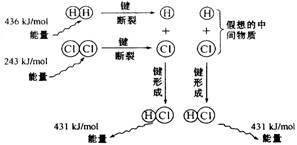
A、1mol H2分子中的化学键断裂时需要吸收436kJ的能量
B、2mol HCl分子中的化学键形成时要释放862kJ的能量
C、2mol HCl分子中的化学键形成时要吸收862kJ的能量
D、此反应的热化学方程式:H2(g)+Cl2(g)=2HCl(g) △H=-183kJ·mol-1
4、根据热化学方程式(在101kPa时)∶
S(s) + O2(g) = SO2(g) ΔH = -297.23kJ/mol
分析下列说法中不正确的是( )
A.S的燃烧热为297.23kJ/mol
B.S(g) + O2(g) = SO2(g) 放出的热量大于297.23kJ
C.S(g) + O2(g) = SO2(g) 放出的热量小于297.23kJ
D.形成1mol SO2的化学键释放的总能量大于断裂1mol S(s) 和1mol O2(g) 的化学键所吸收的总能量
5、肼(N2H4)是火箭发动机的燃料,反应时N2O4为氧化剂,生成氮气和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H= -534.0kJ/mol
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H= -542.7kJ/mol
B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H= -1059.3kJ/mol
C.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H= -1076.7kJ/mol
D.N2H4(g)+ 1/2N2O4(g)= 3/2N2(g)+2H2O(g);△H= -1076.7kJ/mol
6、1g 氢气在氧气中完全燃烧生成气态水,放出热量120.9 kJ,则 ( )
A.反应的热化学方程式:2H2(g)+O2(g)=2H20(g);ΔH=+483.6 kJ·mol一1
B.氢气的燃烧热为241.8 kJ·mol-1
C.1 mol H20(1)的能量大于1 mol H20(g)的能量
D.2 mol H2和1 mol 02的能量总和大于2 mol H2
0(g)的能量
7、已知:101kPa时的辛烷的燃烧热为5518kJ·mol-1,强酸与强碱在稀溶液中发生反应时的中和热57.3kJ·mol-1,则下列热化学方程式书写正确的是(
)
①C8H18(l)+ 25/2 O2(g)=8CO2(g)+9H2O(l) △H=+5518kJ·mol-1
②C8H18(l)+ 25/2 O2(g)=8CO2(g)+9H2O(l)△H=-5518kJ·mol-1
③H++OH-=H2O △H=-57.3kJ·mol-1
④NaOH(aq)+1/2 H2SO4(aq)= 1/2 Na2SO4(aq)+H2O(l)△H=+57.3kJ·mol-1
A.①③
B.②③
C.②④
D.只有②
8.下列有关热化学方程式的叙述正确的是( )
A.已知2H2(g)+O2(g)![]() 2H2O(g)△H=
-483.6 kJ·
mol—1,则氢气的燃烧热为241.8kJ
2H2O(g)△H=
-483.6 kJ·
mol—1,则氢气的燃烧热为241.8kJ
B.已知C(石墨,s)![]() C(金刚石,s)△H>0,则金刚石比石墨稳定
C(金刚石,s)△H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(ag)+HCl(aq)![]() NaCl(aq)+H2O(l)△H=-57.4 kJ·
mol—1
NaCl(aq)+H2O(l)△H=-57.4 kJ·
mol—1
D.己知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2
9、已知下列热化学方程式:
① CH3CHOOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ·mol-1
② C(s)+O2(g)=CO2(g) △H2=-393.5kJ·mol-1
③ H2(g)+1/2O2(g)=H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的焓变为( )
A、-488.3kJ·mol-1 B、-224.15kJ·mol-1 C、488.3kJ·mol-1 D、244.15kJ·mol-1
10、已知如下两个热化学方程式C(s)+O2(g)===CO2(g);△H==-393.5kJ/mol
2H2(g)+O2(g)===2H2O(g);△H===-483.6 kJ/mol
现有0.2mol炭粉和氢气组成的悬浮气体、固体混合物在氧气中完全燃烧,共放出63.53kJ热量。则炭粉与氢气的物质的量之比是 ( )
A.1:1 B.l:2 C.2:3 D.3:2
11、已知31g白磷变成31g红磷放出18.39KJ热量,下列两个反应中:
4P(白磷,s)+5O2(g)=2P2O5(s) △H= -Q1 KJ/mol
4P(红磷,s)+5O2(g)=2P2O5(s) △H= -Q2 KJ/mol
Q1和Q2的关系为( )
A. Q1>Q2
B. Q1=Q2
C.Q1<Q2
D.无法确定
第Ⅰ卷 选择题 答案卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题 共56分)
二、填空题
12、(9分)以下是一些烷烃的燃烧热(KJ/mol)数据,试回答下列问题:
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
⑴已知:物质的能量越高越不稳定,试根据表中有关数据,比较正丁烷、异丁烷的热稳定性:正丁烷 异丁烷。
⑵写出乙烷燃烧的热化学方程式 。
⑶相同质量的烷烃,碳的质量分数越大,燃烧放出的热量 (填“越多”、“越少”、“相同”)。
13、(12分)按下列要求写出热化学方程式:
①用CO气体还原1mol氧化铁固体,放热24.8KJ
②1molHgO(S)分解为液态汞和氧气,吸热90.7KJ
③常温下,3molNO2气体溶于水中,生成硝酸和NO气体,放热138KJ
14、(9分)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol。某同学用22g液化气(以C3H8计)做实验,测定燃烧放出热量有关数据如下:
①完全燃烧生成CO2和H2O(g)时,放出热量a kJ ;
②不完全燃烧生成CO和H2O(g)时,放出热量b kJ;
③不完全燃烧生成CO、CO2和H2O(g)时,放出热量 c kJ ;
请写出(1)能表示液化气燃烧热的热化学方程式
(2)CO的燃烧热为
(3)第③次实验生成CO的物质的量为
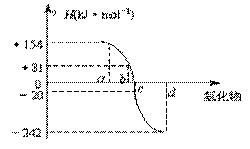
15、(10分)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。下图为氧族元素氢化物a、b、c、
d的生成热数据示意图。试回答下列问题:
分数 姓名 班级
⑴写出氧族元素中含有18e-的两种氢化物的电子式
。
⑵请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系
⑶写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式:
。
16、(16分)将煤转化为水煤气的主要化学反应为C(s)+H2O(g)===CO(g)+H2 (g);
C(s)、CO(g)和H2 (g)完全燃烧的热化学方程式为:
C(s)+ O2
(g)=CO2 (g) ![]() H= —393.5kJ·mol-1
H= —393.5kJ·mol-1
H2 (g)+ 1/2O2 (g)=H2 O(g) ![]() H= —242.0
kJ·mol-1
H= —242.0
kJ·mol-1
CO(g)+ 1/2O2
(g)=CO2 (g) ![]() H= —283.0
kJ/·mol-1 请回答:
H= —283.0
kJ/·mol-1 请回答:
(1)根据以上数据,写出C(s)与水蒸汽反应的热化学方程式_______
(2)比较反应热数据可知,lmolCO(g)和1molH2 (g)完全燃烧放出的热量之和比1molC(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出下列循环图:
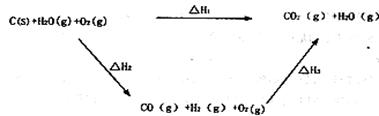
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是 (填“甲”或“乙”);判断的理由是
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇 ②甲醛 ③甲酸 ④乙酸。试分析当CO和H2按1:1的体积比混合反应,合成上述___ (填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
选修四第一章化学反应与能量变化检测题参考答案及评分标准
第Ⅰ卷 选择题 答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | B | C | C | C | C | D | D | C | A | A | A |
12、(9分,每空3分)⑴ <
⑵2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ΔH=-3121.6KJ/mol
⑶越少
13、(12分,每空4分)略
14、(9分,每空3分)
(1)C3H8(g)+5O2(g)===3CO2(g)+4H2O(1) △H=-(2a+176)kJ/mol
(2)(2a-2b)/3 kJ/mol
(3)1.5(a-c)/(a-b)
15、(10分)
⑴![]() (4分,每个2分)
(4分,每个2分)
⑵非金属元素氢化物越稳定,△H越小,反之亦然(3分)
⑶H2Se(g)=Se(s)+H2(g);△H=-81kJ/mol(3分)
16、(16分)
(1)C(s)+H2O(g)=CO(g)+H2
(g) ![]() H=+131.5kJmol-1(3分)
H=+131.5kJmol-1(3分)
(2)乙(2分)甲同学忽略了煤转化为水煤气要吸收热量(3分)(或![]() H1=
H1=![]() H2+
H2+![]() H3且
H3且![]() H2>0)
H2>0)
(3)①减少污染 ②燃烧充分 ③方便 ④直接燃烧水煤气热量大(4分,每个2分)
(4)②④(4分,每个2分)