08级高三上册第三次月考化学试题
考试时间:90分钟 总分:100分
可能用到的原子量:H 1 Al 27 Mg 24 Fe 56 O 16 S 32 Cl 35.5 N 14
第Ⅰ卷 选择题(共45分)
一.选择题(每小题3分,共45分。每小题只有1个选项符合题意)
1、2007年3月21日,我国公布了111号元素Rg的中文名称,该元素名称及所在周期是
A、金旁加仑 第七周期 B、镭 第七周期 C、铼 第六周期 D、氡 第六周期
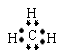 2.下列各种微粒的表示方法中,不正确的是(
)
2.下列各种微粒的表示方法中,不正确的是(
)
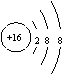 A.甲基的电子式:
B.次氯酸分子的结构式:H—O—Cl
A.甲基的电子式:
B.次氯酸分子的结构式:H—O—Cl
C.硫离子的结构示意图: D.碳-12的原子符号: ![]() C
C
3. 21世纪的重要课题之一是:在探究清楚光合作用和生物固氮历程的基础上,设计优良的催化剂和恰当的反应途径,以便打断下列哪组分子的稳定的化学键
A.H2O、 NH3 B.CO2、 NH3 C.CO2 、N2 D.H2O、NO
4.下列各溶液中,各离子可能大量共存的有
A.含有大量Ba2+的溶液中:HCO3-、Fe3+、Ag+、SO42-、SCN-
B.滴加无色酚酞试液后仍无色的溶液中:Na+、CO32-、K+、Cl-、AlO2-
C.由水电离的c(OH-)=10-5mol·L-1 的溶液中:CH3COO-、C6H5O-、Na+、K+
D.加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、HS-
5.X、Y、Z三种非金属,原子最外层电子数相等,等物质的量的单质X2、Y2、Z2分别与足量钠反应时,反应热为△Hx2>△Hy2>△Hz2,下列判断一定正确的是
A.原子半径:X<Y<Z
B.气态氢化物的稳定性:HX<HY<HZ
C.气态氢化物的沸点:HX>HY>HZ
D.最高价氧化物对应的水化物的酸性可能为:HZO4<HYO4<HXO4
6. 2005年美国《Science》上发表论文,宣布发现了一种Al的超原子结构,这种超原子(Al13)是以1个Al原子在中心,12个Al原子在表面形成的三角二十面体结构。这种超原子具有40个价电子时最稳定。请预测稳定的Al13所带的电荷为
A.+3 B.+2 C.0 D.-1
7.有M、N两溶液,各含有下列十四种离子中的七种离子:Al3+、Cl-、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、NH4+、H+、SO42-、CO32-、AlO2-。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是
A.OH-、S2-、CO32- B. AlO2-、MnO4-、SO42-
C.Cl-、NO3-、SO42- D. MnO4-、SO42-、NO3-
8.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O![]() +O2+xOH—
+O2+xOH— Fe3O4+S4O![]() +2H2O下列说法中,正确的是
+2H2O下列说法中,正确的是
A.每生成1mol Fe3O4,反应转移的电子总数为3mol
B.Fe2+和S2O![]() 都是还原剂
都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
D.x=2
9.目前,关于二氧化碳是否为大气污染有不同的观点。认为“二氧化碳不是大气污染物”的理由是( )
错误!未找到引用源。二氧化碳是重要的化工原料;错误!未找到引用源。二氧化碳是植物光合作用的必需原料;错误!未找到引用源。二氧化碳是无色、无味、无毒的气体;错误!未找到引用源。除二氧化碳外,甲烷、一氧化二氮也是温室气体
(A)错误!未找到引用源。错误!未找到引用源。 (B)错误!未找到引用源。错误!未找到引用源。 (C)错误!未找到引用源。错误!未找到引用源。 (D)错误!未找到引用源。错误!未找到引用源。
10.有Xn+、Ym+、Zn-,已知它们各自带有的电荷数值m>n,且X、Y、Z三种原子的M电子层中的电子数均为奇数。若按X→Y→Z的顺序,下列说法中正确的是( )
A、它们的最高价氧化物的相应水化物的碱性依次减弱,酸性依次增强
B、它们的原子半径依次增大;
C、它们的单质在常温、常压下的密度依次减小
 D、它们的最高价氧化物的水化物都是强电解质
D、它们的最高价氧化物的水化物都是强电解质
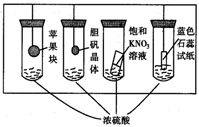
11.在下图所示的实验装置中,实验进行一段时间后,对观察到的现象叙述不正确的是( )
A.苹果块会干瘪
B.胆矾晶体表面有“白斑”
C.小试管内有KNO3晶体析出
D.蓝色石蕊试纸变红
12.对于发生反应M+N=W+V的化学反应中,下列说法正确的是
A、若M、W为单质,N、V为化合物,该反应不一定是置换反应
B、W、V为盐和水,该反应不一定是中和反应
C、若M、N为m克,则反应后W、V的质量和一定是m克
D、反应物M,N的质量比一定等于W,V的质量比
13.下列离子方程式书写正确的是:
A.硫酸亚铁加过氧化氢溶液:Fe2+
+ H2O2 + 2H+![]() Fe3+ + 4H2O
Fe3+ + 4H2O
B.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3- +Ba2++2OH- = BaCO3↓+2H2O+CO32 -
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4- +5NO2- +6H+ = 2Mn2++5NO3- +3H2O
D.铝粉与NaOH的D2O溶液反应:2Al + 2OH- + 2D2O![]() 2AlO2- + H2↑+2D2↑
2AlO2- + H2↑+2D2↑
14.某同学用Na2CO3配制0.10mol·L-1Na2CO3(aq)的过程如下图所示:
|
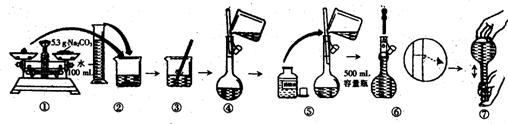
你认为该同学的错误有( )
|
15.右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上
的部分内容。据此下列说法正确的是 ( )
A.该试剂的物质的量浓度为9.2 mol·L—1
B.该硫酸50. 0 mL与足量的铜反应可得到标准状况下SO2 10.3 L
C.配制200.0 mL 4.6 mol·L—1的稀硫酸需取该硫酸50.0 mL
D.该硫酸与等体积的水混合所得溶液的质量分数小于49%
第Ⅱ卷 非选择题(共55分)
二、(本题包括6小题,共55分)
16、(8分)指出在使用下列仪器(已经洗涤干净)或用品的第一操作;
①石蕊试纸(检验气体)
②容量瓶:
③集气瓶(收集氯化氢)
④托盘天平
17.(11分)在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是: . (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物是 .
(2)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象。
| ( )同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 | ||
| 第二种方法 |
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是 .
写出在稀溴化亚铁溶液中通入足量氯气时的离子方程式:
若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行?
理由是:
18.(8分)有一类无机化合反应的通式可以表示为:单质+化合物(1)=化合物(2),请写出满足以下要求的四个此类无机化合反应的化学方程式: ①所涉及的元素的原子序数都小于30 ②4种单质分属4个不同族
(1) ;
(2) ;
(3) ;
(4) 。
19.(10分)某些化学反应可用下式表示
A + B ─→ C + D + H2O
请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式: 。
(2)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
(3)若A为Na2O2,B为硫酸,则C和D的化学式是 。
(4)若A、C均含有铝元素。则C可能是 。
(5)若A为有颜色的金属单质,B为第二周期某种元素的最高价氧化物的水化物,请写出符合上式的化学方程式: 。
20. ( 12分) 某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
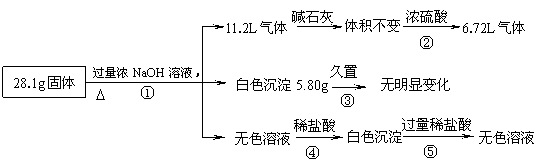

回答下列问题:
⑴混合物中是否存在FeCl2 ___(填“是”或“否”);
⑵混合物中是否存在(NH4)2SO4 ___(填“是”或“否”),你的判断依据是
。
⑶写出反应④的离子反应方程式: 。
⑷请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)
。
⑸把AlCl3溶液中加热浓缩蒸干,不能得到AlCl3晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3结晶。
21.(6分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、A1、Fe三种元素。
【查阅部分资料:草酸铵[(NH4)2C2O4]属于弱电解质;Ca、A1、Fe完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3;pH≥5.5;Fe(OH)3:pH≥4.1)
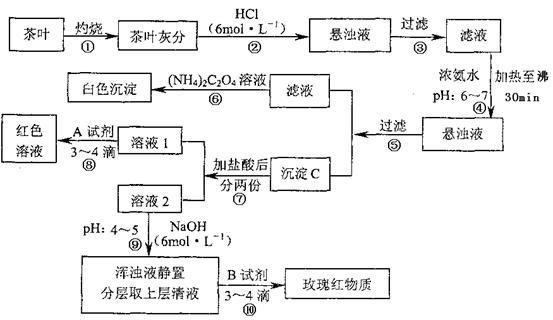
试根据上述过程及信息填空:
(1)步骤④用浓氨水调节pH、加热至沸30min的作用是 。
(2)写出检验Ca2+的离子方程式 。
(3)写出沉淀C所含主要物质的化学式 。
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式 。
(5)步骤⑨的作用是 ,猜测步骤⑩的目的是 。