08级高三上册第二次月考化学试题
考试时间:90分钟 总分:100分 命题人:杨 辉
可能用到的原子量:H 1 C 12 Zn 65 Cu 64 O 16 S 32 Cl 35.5 N 14
第Ⅰ卷 选择题(共45分)
一.选择题(本题包括15小题,每小题3分,共45分。每小题只有1个选项符合题意)
1、许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是
A、氯、溴、碘 B、钠、镁、铝
C、烧碱、氢气 D、食盐、淡水
2. 请你运用所学的化学知识判断,下列有关化学观念的叙述错误的是
A、 几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B、 用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒
C 、 一定条件下,金属钠可以成为绝缘体
D 、 一定条件下,水在20℃时能凝固成固体
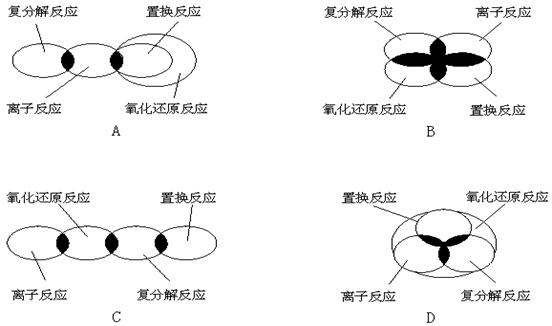
3、离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系表示,其正确的是:( A )
4、膳食中的钠主要存在于食盐中,它是烹饪中重要的调味品,也是保证肌体水分平衡的最重要物质。钠缺乏症可造成生长缓慢、食欲 减退、由于失水体重减轻、肌肉痉挛、恶心、腹泻和头痛。膳食中长期摄入过多的钠将导致高血压。这里涉及到的钠指的是 ( )
A.钠单质 B.食盐 C、钠离子 D.碳酸氢钠
5. 下列离子反应方程式正确的是
A.澄清石灰水来吸收氯气:Cl2+OH-=Cl-+ClO-+H+
B.将金属Na加入冷水中:2Na+2H2O=2Na++2OH-+H2↑
C.向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D.在碳酸氢钙溶液中加入少量苛性钾溶液:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
6. 常温下,下列溶液中一定能大量共存的离子组是
A.含有大量S2-的溶液:ClO-、Na+、Cl-、CO32-
B.无色澄清溶液:MnO4-、SO42-、K+、Fe3+
C.能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+
D.水电离产生的c(H+)=1×10-12mol/L的溶液:HCO3-、NH4+、Cl-、Ca2+
7. 设NA表示阿伏加德罗常数,下列说法中不正确的是
A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D.125gCuSO4·5H2O晶体中含有0.5NA个Cu2+
8.下表是一些烷烃的燃烧热:
| 化合物 | 燃烧热(kJ·mol。) | 化合物 | 燃烧热(kJ·mol。) |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1559.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2一甲基丁烷 | 3531.3 |
下列说法中正确的是
A.热稳定性:正丁烷>异丁烷
B.正戊烷的燃烧热大约在3540 kJ·mol-1左右
C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g) 4CO2(g)+6H2O(g);AH=一1559.8 kJ·moL。
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
9.下列变化或数据与氢键无关的是
A.SbH3的沸点比PH3高
B.氨分子与水分子形成一水合氨
C.甲酸蒸气的密度在373K时为1.335g·L-1,在293K时为2.5 g·L-1
D.丙酮在己烷和三氟甲烷中易溶解,其中在三氟甲烷中溶解时的热效应较大
10、存放下列试剂的方法中,有错误并且会引起危险的是:
A.白磷浸在盛有CS2的敞口试剂瓶中 B.金属钠浸在盛有煤油的试剂瓶中
C.碳酸钠饱和溶液放在带玻璃塞的试剂瓶中 D.溴水放在带橡皮塞的试剂瓶中
11、已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是( )
A.A、B、E一定在不同周期 B.D为第二周期
C.A、D可能在同一主族 D.C、D的单质可能化合为离子化合物
12.通过复习总结,你认为下列对化学知识概括合理的是
A.氧化物不可能是还原产物,只可能是氧化产物
B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
13.下列物质不能由化合反应得到的是
A.FeCl3 B.Fe(OH)3 C. Fe(OH)2 D.FeCl2
14.某学生用 NaHCO3和 KHCO3 组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)。下列分析推理不正确的是
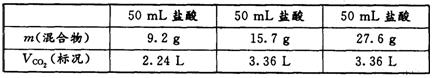
A.盐酸的物质的量浓度为 3.0 mol · L 一1
B.根据表中数据不能计算出混合物中 NaHCO3的质量分数
C.加入混合物 9.2g 时盐酸过量
D.15.7g 混合物未与盐酸完全反应
15.金属铜的提炼多从黄铜矿开始.黄铜矿的焙烧过程中主要反应之一的化学方程式
![]()
A.方框中的物质应为 Cu2S B.O2只作氧化剂 C.SO2 既是氧化产物又是还原产物
D.若有 1 molSO2 生成,则反应中有 4 mol 电子转移
总分_______________
 第Ⅰ卷 答题卡(共45分)
第Ⅰ卷 答题卡(共45分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 答案 |
第Ⅱ卷 非选择题(共55分)
二、(本题包括6小题,共55分)
16、I. (6分)试回答下列问题:
(1)量筒内液体体积正确读数为10.0mL时,全部倒入烧杯内的实际体积___ __10.0mL;100mL容量瓶内液面正好达到刻度线,全部倒入烧杯内的实际体积_____ ___100mL。(填:大于、等于或小于)
(2) 中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、_________、_____________。
(3) 欲量取20.00mL Na2CO3溶液,应选用的仪器是_____ _______。
(4)在硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行
__ _ 次。
II.(10分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O NH4HCO3 ; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
![]() 2NaHCO3 Na2CO3+CO2↑+H2O
2NaHCO3 Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 _______________(填字母标号)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
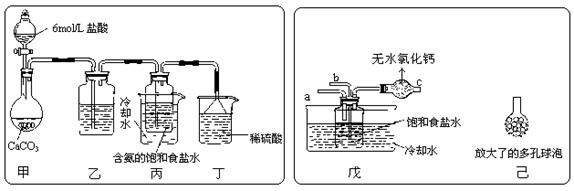
试回答下列有关问题:
![]() (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是
(填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:
_____________________________________________________________________________________________________________________________________ 。
17.I(6分)已知氨气跟氯气可迅速反应生成氯化铵和氮气。当转移的电子总数为a个时,生成的氮气的物质的量bmol.
(1)写出该反应配平的化学方程式并标出电子转移方向和数目:
(2)该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为 。
(3)阿伏加德罗数常数为(用含a、b的代数式表示) 。
II.(3分)混合物平均摩尔质量通常可表示为:![]() ,利用此概念可以讨论许多化学问题:
,利用此概念可以讨论许多化学问题:
⑴相同条件下,潮湿空气的密度 (选填“>”、“<”或“=”)干燥空气的密度,理由是:
;
⑵在一定条件下的密闭容器中,存在如下平衡:C(s)+H2O(g)![]() CO(g)+H2 (g);假如温度保持不变并加压,则
CO(g)+H2 (g);假如温度保持不变并加压,则![]() (混合气)将
(混合气)将
(填写“变大”、“变小”或“不变” “无法确定”);
18.(5分)两种非金属元素X、Y在元素周期表中相隔一个周期,它们的单质Xm、Yn和水在一定条件下能发生反应:
![]() Xm+Yn+H2O HY+H3XO4+XH4Y(未配平)。(m、n
均为大于l的正整数)
Xm+Yn+H2O HY+H3XO4+XH4Y(未配平)。(m、n
均为大于l的正整数)
(1)若Xm、Yn在常温下均为常见固体,则Xm是_________;Yn是___________。
(2)根据(1)的判断,完成(配平)上述化学方程式
____________ ___ ____________________
(3)试解释下列两反应能进行的原因:
①HY(aq)+NaH2XO4(aq) H3XO4(aq)+NaY (aq),理由是
_______________________ _________________;
②H3XO4(浓)+NaY(固) HY+NaH2XO4,理由是_______
_______
_______________________ ____________________
19、(9分) X、Y、Z、W都是短周期元素,原子半径W>Z>X>Y。X、Y、Z、W元素原子的最外层电子数之和是16,已知X、Y两元素处于同一周期;X、Z处于同一主族;Z原子核内的质子数等于X、Y原子核内的质子数之和;Z原子最外层上的电子数是W原子最外层上电子数的2倍。Z元素形成的单质能与NaOH溶液反应。
请回答下列问题:
(1)在下面元素周期表中的相应位置填写X、Y、Z、W的元素符号。
|
|
|
| |||||||||||||||
|
|
|
|
|
|
|
|
|
| |||||||||
|
|
|
|
|
|
|
|
| ||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2)X、W、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是(填元素的最高价氧化物的水化物的化学式).
___________________ ____。
(3)W单质可与沸水发生反应,反应的化学方程式是
____________________ (4)Y和Z两种元素可形成化合物ZY2,某种ZY2晶体结构相当于把金刚石中的原子均换成Z原子,且在每两个Z原子连线的中点放置一个Y原子,则此晶体是_______ _晶体,此晶体中由Z、Y原子组成的最小环上占有__________个Z原子。
20.(8分)下图是部分短周期元素的单质及其化合物的转化关系(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体,且B、C气体是空气的主要成分;(b)反应①、③是化工生产中的重要反应;(c)化合物E是形成酸雨的污染物之一,化合物G是常用的氮肥,化合物H的摩尔质量为99 g·moL-1。请按要求填空:
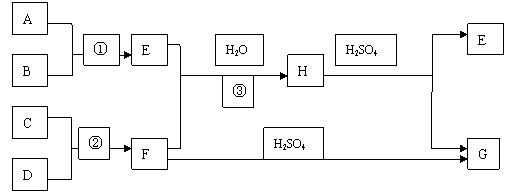

(1)反应③的化学方程式为_____________ ___________
(2)C的电子式为________ ____F的空间构型__ _____ ____
用电子式表示F的形成过程:___ ____________________
(3)化合物E与NaClO溶液反应的离子方程式为
________________ _ _____
21.(8分)碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:
6I2+11KClO3+3H2O 6KH(IO3)2+5KCl+3Cl2
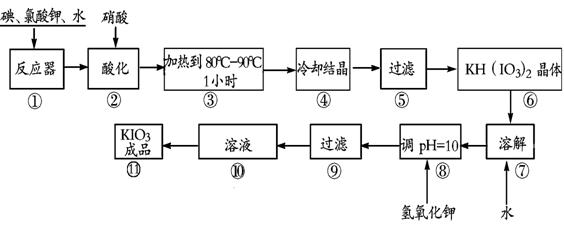
(1)步骤①反应器发生的反应中,转移电子总数为 ;
(2)步骤②中,用硝酸而不用HI,其原因可能是
;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |