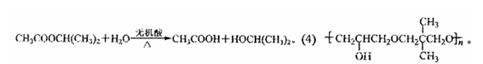高三化学上学期综合测试试题
化学试题
(考试时间:120分钟)
本卷可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 K 39 Ca 40 Mn 55
请将答案填入答题卡、或答卷的指定位置
第Ⅰ卷 选择题(共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.下列叙述正确的是 ( )
A.目前加碘食盐中主要添加的是KIO3
B.日常生活中无水乙醇常用于杀菌消毒
C.绿色食品不是含任何化学物质的食品
D.在空气质量日报中CO2含量属于空气污染指数
2.以氮化硅(Si2N4)和氧化铝(Al2O3)为原料,采用高压烧结或热压工艺制备赛伦(Sialan)。赛伦的化学通式为Si6—xAlOxN8—x,以耐高温、高强度、超硬度、耐磨损、抗腐蚀等性能为主要特征,因此,在冶金、机械、光学、医学等领域有重要应用。它属于 ( )
A.金属材料 B.有机高分子材料
C.新型无机非金属材料 D.无机高分子材料
3.若NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.0.84gNaHCO3晶体中阳离子和阴离子总数为0.03NA
B.a gO2和O3的混合气体中所含分子数一定为![]()
C.标准状况下,2.24L四氯化碳含碳原子数为0.1NA
D.1.8g H2O含有的质子数NA
4.下列物品或设备:①水泥路桥 ②门窗玻璃 ③水晶镜片 ④石英钟表 ⑤玛瑙手镯 ⑥硅太阳能电池 ⑦光导纤维 ⑧计算机芯片。所用材料为SiO2或要用到SiO2的是 ( )
A.⑥⑧ B.①②⑦⑧ C.①②③④⑤⑦ D.全部
5.下列物质的保存方法正确的是 ( )
A.氢氟酸保存在用塑料塞的玻璃瓶中
B.氢氧化钠溶液盛放在用玻璃塞的玻璃瓶中
C.氯水贮存于棕色玻璃瓶中
D.硅酸钠密封保存玻璃塞的玻璃瓶中
6.下列现象或应用不能用胶体知识解释的是 ( )
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.土壤表面积巨大且一般带负电,能吸收NH+4等营养离子,土壤具有保肥能力
C.水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染
D.氯化铝溶液中加入碳酸钠溶液会出现白色沉淀
7.下列各组溶液中所含溶质的物质的量相等,将其充分混合后不会产生沉淀的是 ( )
A.CaCl2、NaHCO3、KOH B.MgCl2、Ba(OH)2、HCl
C.FeCl3、H2S、HCl D.NaAlO2、K2CO3、NH2·H2O
8.ClO2或Cl2的稀溶液可作为常用消毒剂,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-。下列有关说法中正确的是 ( )
A.ClO2的分子结构呈V型,属非极性分子
B.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3+2NaClO3+H2SO4 = 2Na2SO4+2ClO2↑+H2O
C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害
D.ClO2中氯元素是+4价,具有很强的氧化性,其消毒效率(以单位物质的量得电子的数目表示)是Cl2的5倍
9.痕检是公安机提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中的一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心地涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。用下列化学式表示这3种物质都正确的是 ( )
A.①AgNO2②NaCl③AgCl B.①AgNO3 ②NaBr ③AgBr
C.①AgCl ②AgNO3 ③NaCl D.①AgNO3 ②NaI ③AgI
|
A.碘片 B.氨化铵 C.碘化铵 D.碳酸钠
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
11.在下列变化中,不属于化学变化的是 ( )
A.SO2使品红试液褪色 B.活性炭使红墨水褪色
C.氯水使紫色石蕊试液褪色 D.O3使某些染料褪色
12.关于某无色透明溶液中所含离子的鉴别,下列叙述正确的是 ( )
A.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定有SO2-4
B.通入Cl2后,溶液变为黄色,加入淀粉后溶液变蓝,则原溶液中一定有I-
C.加盐酸,生成无色无味气体能使饱和的澄清石灰水变浑浊,则原溶液中一定有CO2-3
D.加入NaoH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定有NH+4
13.下列关于有机化合物的说法正确的是 ( )
A.乙醇和乙酸中一定共面的原子数相等
B.高锰酸钾可以氧化苯和甲烷
C.甲烷和乙烯都可以与氯气反应
D.乙烯可以与氢气发生加成反应,苯不能与氢气加成
14.某无色碱性溶液,该溶液中能大量共存的离子是 ( )
A.NH+4、NO-3、HS-、Cl- B.Na+、Al3+、K+、AlO-2
C.Ca2+、K+、SO2-3、、Na+ D.K+、Na+、SO2-4、NO-3
15.铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱币,因而有“货币金属”之称。由于铁的金属性比铜、银、金强,相对而言,人类认识铁稍晚。某研究性学习小组为了证明铁的金属活动性比铜强,他们设计了如下方案
(1)铁片置于硫酸铜溶液中有铜析出
(2)铁、铜和氯气反应分别生成FeCl3和CuCl2
(3)足量的铁粉和铜粉和浓硫酸反应生成FeSO4和CuSO4
(4)铜片置于FeCl3溶液中铜片逐渐溶解
(5)把铁片和铜片置于盛有稀硫酸的烧杯中,交用导线连接,铁片上无气泡产生,而铜片上有气泡产生
(6)把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生。以上设计合理的有 ( )
A.两种方案 B.三种方案 C.四种方案 D.五种方案
16.有关物质燃烧时火焰颜色描述错误的是 ( )
A.氢气在氯气中燃烧——苍白色 B.钠在空气中燃烧——黄色
C.乙醇在空气中燃烧——淡蓝色 D.硫在氧气中燃烧——绿色
17.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO2-4+10H2O = 4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备——2Fe(OH)3+3ClO-+4OH-= 2FeO2-4+3Cl-+5H2O
干法制备——2FeSO4+6Na2O2 = 2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法中正确的是 ( )
A.高铁酸钾与水反应时,水发生还原反应
B.湿法中每生成1molNa2FeO4共转移3mol电子
C.干法中每生成1molNa2FeO4共转移4mol电子
D.K2FeO4处理水时,不仅能杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降
18.等物质的量的下列物质:①NaHSO4 ②Ca(H2PO4)2 ③Si ④Al2(SO4)3
|
⑤ 分别与足量的NaOH溶液反应,耗碱最由多到少的顺序正确的是 ( )
A.②⑤④③① B.④②③⑤① C.④②⑤③① D.④⑤②③①
19.下列有关环境问题的说法正确的是 ( )
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH小于5.6的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
20.a mol FeS与b mol FeO投入到VL、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为 ( )
A.(a+b)×63g B.(a+b)×189g C.(a+b)mol D.![]() mol
mol
|
|
二、本题包括3小题
21.某研究小组成员在讨论鉴别浓硫酸和稀硫酸的方案时,设计如下方案:
| 操作 | 预测现象并做出结论 | |
| 甲 | 分别将硫酸滴在火柴梗上 | 变黑者为浓硫酸 |
| 乙 | 分别加入小块金属铝片 | 产生刺激性气味者为浓硫酸 |
| 丙 | 分别加入到盛水的试管中 | 放热者为浓硫酸 |
| 丁 | 分别用玻璃棒蘸浓氨水靠近酸的瓶口 | 冒白烟者为浓硫酸 |
| 戊 | 分别加到CuSO4·5H2O晶体中 | 晶体表面由蓝变白者为浓硫酸 |
(1)其中可行的是 。
(2)其中一个稍作改进就能成为可行的是 ,改进方法是 。
(3)完全错误的是 ,因为 。
(4)用98%(ρ=1.84g/mL)的浓硫酸配制4.60mol/L的稀硫酸100mL,则应用量筒量取98%的浓硫酸的体积是 mL
22.在实验室里可用下图所示装置制取氯酸钾、次氯钾钠和探究氯水的性质。
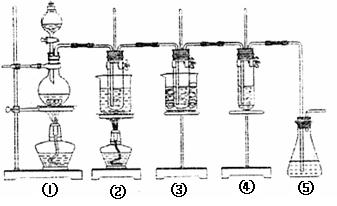
图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,向烧瓶中加入适量浓盐酸的操作是 。
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是: 。
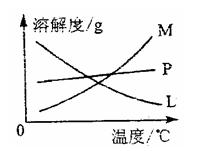
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是 (填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验名称)。
(3)本实验中制取氯酸钾的离子方程式是 。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液晨初从紫色逐渐变为 色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | |
| 然后溶液从无色逐渐变为 色 |
23.Ag/α—Al2O3是石油化学工业的一种重要催化剂,其中Ag起催化作用,α—Al2O3是载
体且不溶于硝酸,该催化剂的回收实验如下图所示。其中的转化反应为:
6AgCl+Fe2O3→3Ag2O+2FeCl3
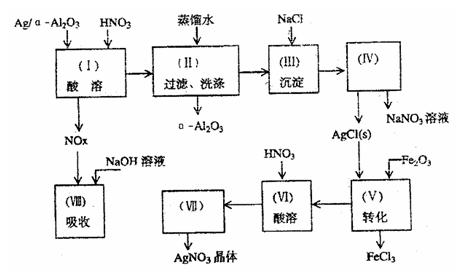
阅读上述实验流程,完成下列填空:
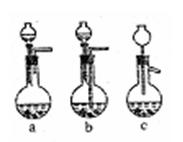 (1)Ag/α—Al2O3加酸溶解应该选择选用装置
(1)Ag/α—Al2O3加酸溶解应该选择选用装置
(选填a、b、c、)。
(2)在实验操作(II),如果用自来水代替蒸馏水进行
洗涤,将会发生化学反应的离子方程式
。
(3)实验操作(IV)的需玻璃仪器为 (填写三种)。
(4)实验操作(VII)从AgNO3溶液获得AgNO3晶体需要进行的实验操作依次为: (多选扣分)。
(a)蒸馏 (b)蒸发 (c)灼烧 (d)冷却结晶 (e)过滤
(5)已知:NO+NO2+2NaOH = 2NaNO2+H2O;2NO2+2NaOH = NaNO3+NaNO2+H2O
NO和NO2的混合气体的组成可表示为NOx。该混合气体通入NaOH溶液被完全吸收时,x的值为 。
(a)x<1.5 (b)X=1.2 (c)x≥1.5
(6)已知Ag/α—Al2O3中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为 和 。
三、本题包括3小题。
24.海水的综合利用可以制备金属镁,其流程如下图所示:

(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式。 、 。
(2)用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是 。
(3)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
。
25.已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的菱锰矿(MnCO3)(贫矿)转化为高品位“菱锰矿砂”的绿色工艺。该工艺流程如下图所示:
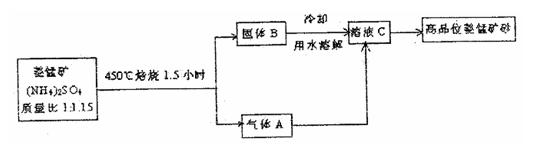
回答下列问题:
(1)锰元素位于元素周期中第 周期 族。
(2)气体A中含有两种气体,溶液C与气体A发生反应的化学方程式为
(3)锰的化合物用途广泛,例如MnO2KMnO4都是得要的锰化合物
MnO2可用于制备KMnO4,一般是先由MnO2在碱性条件下与O2反应制备得到K2MnO4,再由K2MnO4通过以下两种方式制备KMnO4。
方法一:电解法:2K2MnO4+2H2O=2KMnO4+2KOH+H2↑
方法二:CO2法:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
①写出MnO2得到K2MnO4的化学方程式 。
②以上两种制备方法,方法一相对于方法二,所具有的优点是:
。
③KmnO4粉末在低温下与浓H2SO4作用,可生成油状液体,它在0℃以下是稳定的,室温下会立即发生爆炸分解,分解产物为MnO2和O2,则该物质的化学式为
。
26.将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下在石膏转化为硫酸钾和氯化钙的工艺流程示意图。
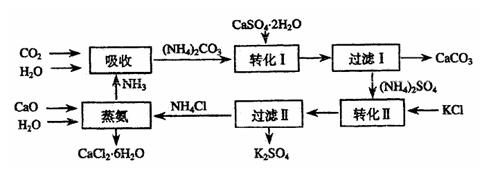
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式: 。
(3)过滤I操作所得固体中,除CaCo3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤I操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO2-3的方法是:
。
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体 。
(6)氯化钙结晶水合物(CaSO4·6H2O)是目前常用的无机储热材料,选择的依据是
。
a.熔点较低(29℃熔化) b.能导电 c.能制抑 d.无毒
(7)上述工艺流程中体现绿色化学理念的是
。
27.石油资源紧张曾是制约我国轿车业发展,尤其是制约轿车进入家庭的重要因素。据2001年5月28日某媒体报道,中国宣布将推广“车用乙醇汽油”。所谓乙醇汽油就是在汽油中加入适量乙醇混合而成的一种燃料。
(1)乙醇燃料时如果氧气不足,可能还在CO生成。请写出乙醇不完全燃烧生成CO2、CO、H2O(其中生成的CO2与CO的质量比为11:14)的化学反应方程式
(2)某种天然高分子化合物X在酶的作用下可生成一种化合物Y,Y在另一种酶的作用下可生成乙醇,试写出Y的结构简式 ,并根据Y的结构特点指出它可能发生的主要化学反应类型是 。
(3)工业上还可以用石油裂解的重要产品——乙烯来制取乙醇。请写出由乙烯制乙醇的化学反应方程式: 。
(4)车用乙醇汽油称为环保燃料,其原因是 。
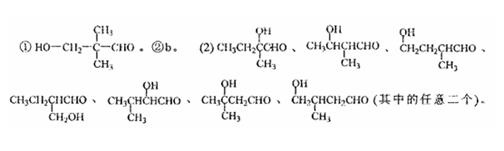
28.碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,
分子中氢原子个数为氧的5倍。
(1)A有2个不同的含氧官能团,一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基因。
①A的结构简式是 。
②A不能发生的反应是(填写序号字母) 。
a.取代反应 b.消去反应 c.酯化反应 d.还原反应
(2)写出两个A具有相同官能团、并带有支链的同分异构体的结构简式: 。
(3)A还有另一种酯烦分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程是 。
(4)已知环氧氯丙烷可与乙二醇发生如下聚合反应:
|
B也能与环氧氯丙烷发生类似反应生成高聚物,该高聚物的结构简式是
。
参考答案
1.A 2.C 3.D 4.C 5.C 6.D 7.D 8.B 9.A 10.B
11.B 12.BD 13.C 14.D 15.A 16.D 17.BD 18.C 19.AC 20.BD
|
(2)乙 加热
(3)丁 硫酸是高沸点酸,没有挥发性。
(4)25.0
22.(1)先打开分液漏斗上面的塞子,再打开分液漏斗的旋塞,使浓盐酸滴入烧瓶中。
(2)碱溶液(或反应物)的浓度不同,反应温度不同;M:过滤。
(3)3Cl2+6OH-=ClO-3+5Cl-+3H2O
(4)
| 红 | |
| 氯气与水反应生成HclO将石蕊氧化为无色物质 | |
| 黄绿 | 继续通入的氯气溶于水使溶液呈黄绿色 |
23.(1)a (2)Ag+ + Cl- = AgCl↓
(3)漏斗、烧杯、玻璃棒
(4)b、d、e (5)c
(6)催化剂的质量,AgNO3的质量
24.MgCl2·6H2O Mg(OH)Cl + HCl↑+ 5H2O↑
MgCl2·6H2O MgO + HCl↑+ 5H2O↑或Mg(OH) Cl=== MgO + HCl↑
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2·6H2O受热产生的水气,故能得到无水MgCl2 (2)加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤。
25.(1)四 VIIB (2)MnSO4+2NH3+CO2+H2O = MnCO3↓+(NH4)2SO4
(3)2MnO2+4KOH+O2 = 2K2MnO4+2H2O
方法一可使K2MnO4完全转变成KMnO4,副产品KOH收回后可用于MnO2的碱熔氧化;
得到的KMnO4较纯净。Mn2O7
26.(1)CaCO3; NH3; H2O
(2)CaSO4+CO2-3 = CaCO3↓+SO2-4。
(3)CaSO4
(4)将滤液滴加到盐酸中产生气泡。
(5)54g
(6)a;d。
(7)碳酸钙用于制水泥原料、硫酸钙,氯化钾转化为硫酸钾和氯化钙,氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中)
27.(1)3CH3CH2OH + 7O2 2CO2+4CO+9H2O
(2)CH2OH(CHOH)4CHO 氧化、加成(还原)与酯化反应
(3)CH2=CH2+H2O CH3CH2OH
(4)能有效降低汽车尾气带来的严重大气污染,改善环境质量
28.(1)
(3)