高三化学十二校第一次联考模拟试卷
班级 姓名 学号
可能用到的原子量:H 1 Li 7 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5
Fe 56 Cu 64 Zn 65 Br 80 Ag 108 I 127 Ce 140 Pb 207
一单项选择题(本题包括8小题,每小题4分,共32分。每小题只是一个选项符合题意)
 1.
右图是同学们经常使用的某品牌修正液包装标签。小明仔细阅读
后, 结合自己的生活经验和所学知识得出了该修正液的某些性质,小明的推测中不合理的是( )
1.
右图是同学们经常使用的某品牌修正液包装标签。小明仔细阅读
后, 结合自己的生活经验和所学知识得出了该修正液的某些性质,小明的推测中不合理的是( )
A.修正液是一种胶体,均一、透明 B.修正液中含有的化学物质有毒
C.修正液的成分对纸张不具有腐蚀性 D.修正液的溶剂易挥发、易燃
2.少量下列物质在试管中加热,最后无固体残留物的是 ( )
A.NH4HCO3 B.Cu(NO3)2 C.Fe(OH)3 D.KNO3
3.以下说法中能证明无色透明液体是纯净水的是 ( )
A.测得该液体pH=7 B.电解该液体得到氢气和氧气,且其体积比为2:1
C.向其中投入金属钠,钠于液面上迅速游动,并发出丝丝声 D.在l.0l×105Pa压强下测得沸点为373.15K
4.下列各组物质熔化或气化时,所克服的微粒间的作用力属同种类型的是( )
A.SiO2和生石灰的熔化 B.钠和铁的熔化
C.碘和NH4Cl的气化 D.晶体硅和晶体硫的熔化
5.将某溶液滴入Fe(OH)3溶胶内,开始时产生沉淀,继续加入时沉淀又溶解,该溶液是( )
A.2mol·L-1H2SO4溶液 B.2mol·L-1NaOH溶液
C.2mol·L-1MgSO4溶液 D.硅酸溶液
6.N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)====
O2(g)====![]() N2(g)+H2O(g);ΔH=+267 kJ·mol-1
N2(g)+H2O(g);ΔH=+267 kJ·mol-1
B.N2H4(g)+O2(g)====N2(g)+2H2O(l);ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH=+534 kJ·mol-1
D.N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH=-534 kJ·mol-1
7.下列离子反应方程式书写正确的是( )
A.在Ba(OH)2溶液中加入少量的硫酸氢钠溶液Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
B.向次氯酸钙溶液中通入SO2气体Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.标准状况下,将112mLCl2缓慢注入10mL 1mol·L-1的FeBr2溶液中
2Fe2++4Br-+3Cl2 =2Fe3++6Cl-+2Br2
|
+HCO![]()
8.某碱金属元素A(此处用A代替其元素符号),其原子半径比钠原子半径大,则下列关于A的推论不正确的有( )
A.A原子的最外电子层上只有1个电子 B.A单质和水反应比钠和水反应剧烈
C.A的氢氧化物的碱性比NaOH碱性强
D.A的单质和氧气反应比钠和氧气反应剧烈,且反应产物一定是A2O
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9. 已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是( )
A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2 B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体有可能使湿润的淀粉KI试纸最终仍呈白色
D.实验②证明Fe2+既有氧化性又有还原性
10.可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个电极反应( )
①Br2+2e=2Br- ②2Br-—2e=Br2 ③Zn-2e=Zn2+ ④Zn2++2e=Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是
A.②和③ B.②和① C.③和① D.④和①
11、设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A、28 g乙烯和28g丙烯中均含有6NA对共用电子对
B、在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2NA
C、7.8 g Na2O2含有的阴离子数目为0.1 NA
D、在含4 mol Si-O键的石英晶体中,氧原子的数目为4NA
12、已知NaHSO4在水中电离方程式为:NaHSO4=Na++H++SO42-.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,对于该溶液,下列叙述中不正确的是( )
A、该温度高于25℃ B、水电离出来的c(H+)=1×10-10mol·L-1
C、c(H+)=c(OH-)+c(SO42-) D、该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好是中性
13.下列实验方案合理的是 ( )
A.用饱和碳酸钠溶液除去乙酸乙酯中混有的乙酸等杂质
B.用加入浓溴水的方法分离苯和苯酚的混合物
C.制备FeCl3溶液时,先将固体溶于较浓盐酸,再加水稀释
D.用润湿的pH试纸测量某酸溶液的pH
14.某温度下,碳酸钠饱和溶液的质量分数为a%,向其中加入x molNa2CO3∙5H2O或ymolNa2CO3,可析出相同质量的Na2CO3∙10H2O,则下列叙述正确的是( )
A.a%可能为39%,x一定大于y B.a%可能为39%,x可能大于、等于、小于y
C.a%可能为30%,x一定大于y D.a%可能为30%,x可能大于、等于、小于y
15.将甲和乙气体同时通入过量丙溶液中,可能产生沉淀的组合是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | Ca(OH)2 |
| ② | HCl | CO2 | Ca(OH)2 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | NO2 | SO2 | CaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| ⑥ | O2 | NH3 | AlCl3 |
A.①②⑤ B.①③④⑤⑥ C.①②③④⑤ D.全部
16.某容积可变的密闭容器中放入一定量的A和B的混合气体,在一定条件下发生反应∶
A(g)+2B(g)![]() 2C(g)。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时C气体的体积为50%,则下列推论正确的是 ( )
2C(g)。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时C气体的体积为50%,则下列推论正确的是 ( )
A.原混合气体的体积为1.5V B.原混合气体的体积为1.25V
C.反应达到平衡时,气体A消耗了0.5V D.反应达到平衡时,气体B消耗了0.5V
三、(本题包括2小题,共22分)
17.(10分)根据测定硫酸铜晶体中结晶水含量的实验,填写下列空白:
⑴ 有下列仪器,本实验中需要的仪器是(填写字母)___________________________,除上述仪器外,还需要的仪器是(填仪器名称): ________________________________。
A、带砝码的托盘天平 B、研钵 C、试管夹 D、酒精灯 E、蒸发皿
F、玻璃棒 G、坩埚 H、干燥管 I、石棉网 J、三角架
⑵ 本实验至少需要加热_____________次,至少需要称量__________次;
⑶ 某学生实验得到以下数据:加热前容器的质量为m1,容器和晶体的总质量为m2,加热后容器和无水CuSO4的总质量为m3。请写出结晶水含量(ω)的计算公式并求出CuSO4·nH2O中n的值(用ml、m2、m3表示): ω= ____________________,n = _____________________
⑷ 若ml = 5.4g、m2 = 7.9g、m3 = 6.8g,该生测得实验结果偏高还是偏低? _______________
从下列分析中选出该生实验产生误差的原因可能是(填写字母) ___________________
A、加热前称量时容器未完全干燥 B、最后两次加热后的质量差大于0.1g
C、加热后容器未放在干燥容器中冷却 D、加热过程中有少量晶体溅出
E、加热后的粉末中有少量黑色固体
18.(12分)实验室用下列装置所示的流程进行气体性质实验。图中用箭头表示气体的流向,A为一种纯净、干燥的气体,B是另一种气体,己中有红棕色气体出现。实验中所用的药品只能从下列物质中选取:Na2CO3、NaHCO3、Na2O、Na2O2、NaCl、无水CaCl2、(NH4)2CO3、碱石灰等固体和蒸馏水。
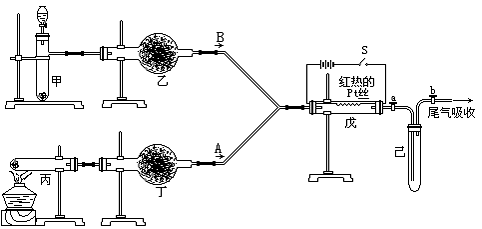
根据图中装置和现象回答:
(1)丙中发生反应的化学方程式为______________________ ___。
(2)丁中应选用的干燥剂是___ __,为什么不选用所给的另一种干燥剂__ __。
(3)甲中发生反应的化学方程式_________________ ____。
(4)戊中发生的主要反应的化学方程式 _。此反应是吸热反应还是放热反应__ __,估计可看到什么现象足以说明你的判断________________。
(5)当己中充满红棕色气体后,停止给丙加热并关闭a、b两个活塞。若将己浸入冰水中,则己中将有什么现象发生?简述发生此现象的原因______ ____。
四、(本题包括2小题,共18分)
19.(8分)已知:氧化性:KMnO4>HNO3;Bi位于周期表中VA,+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________________;
(2)实验④中的现象为:_______________ ;
(3)实验②③反应的离子方程式分别是: _________________、_____________________ __。
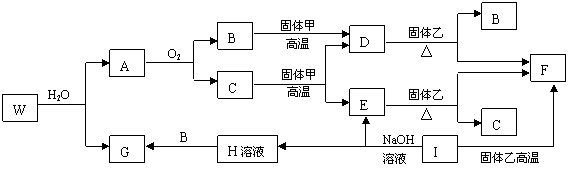 20.(10分)已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。G为白色胶状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液。A在常温下为气态,与氧气完全反应时的体积比是1:2。W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为1:3:3:1。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
20.(10分)已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。G为白色胶状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液。A在常温下为气态,与氧气完全反应时的体积比是1:2。W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为1:3:3:1。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
| |
(2)上述转化中,①C→E ②D→F ③E→F ④I→F ⑤I→E ⑥A→B 其中属于置换反应的是(填序号) ;
(3)写出W和水反应的化学方程式____________________________________________,
I和NaOH溶液反应的离子方程式________________________________________。
五、(本题包括1小题,共10分)
21.有X、Y、Z三种元素,已知:①X2-、Y—均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。请回答:
(1)Y的最高价氧化物对应水化物的化学式是 。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是 ,
此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通过直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为 。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若1.5×6.02×10![]() 个电子转移时,该反应的化学方程式是
。
个电子转移时,该反应的化学方程式是
。
六、(本题包括2小题,共18分)
22、(8分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是电子层数的2倍;C的最高价氧化物对应的水化物与其氢化物反应生成一种盐x;E与A同主族;A、B、C这三种元素,每一种与D都能形成元素的原子个数比不相同的若干种化合物。
(1)写出元素的名称:C____________________.E___________________
(2)画出D的原子结构示意图____________________________
(3)B的最高价氧化物的电子式是____________________________
(4)盐X的水溶液显酸性原因是___________________.(用离子方程式说明)。
23、(10分)(1)CuI是一种不溶于水的白色固体,它可以由反应:2Cu2+ + 4I– 2CuI↓+ I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。电解开始不久阴极区溶液呈红色,而阳极区溶液呈现蓝色,对这个现象解释正确的是:_____________(填序号)。
①阴极电极反应2H+ + 2e – H2↑,使c (OH – ) > c (H+)
②阳极2Cu + 4I – – 4e – 2CuI↓+ I2,I2遇淀粉变蓝
③阳极Cu – 2e – Cu2+,Cu2+ 显蓝色
④阳极2I – – 2e – I2,碘遇淀粉变蓝
(2)剪约6 cm长,2 cm宽的铜片和铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2 cm),将铜片与铝片分别和电流表的“+”、“–”端相连结,电流表指针调到中间位置,取50 mL两只小烧杯,在一只烧杯中注入40 mL浓HNO3,另一只烧杯中注入40 mL稀硫酸,试回答下列问题:
①两电极同时插入稀H2SO4中,原电池的负极为______(填“铝”或“铜”)极,铝片上的电极反应式为:____________________________。电流表指针偏向________(填“铝”或“铜”)
②两电极同时插入浓HNO3中,原电池的负极为_________(填“铝”或“铜”)极,铝片上的电极反应式为:_______________。电流表指针偏向________(填“铝”或“铜”)
七、(本题包括2小题,共18分)
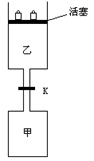 24、(8分)如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V
L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)
24、(8分)如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V
L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)![]() C(g)
C(g)![]() +2D(g);ΔH<0
+2D(g);ΔH<0
达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
(1)乙中B的转化率为 ;
(2)甲中D和乙中C的物质的量比较: (填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为 (用含V的代数式表示,连通管中气体体积忽略不计。)
25.(10分)将Cu与Fe2O3的混合粉末a g与1mol/L硫酸进行反应。
(1)若固体恰好完全溶解,消耗硫酸的体积为0.3L,且所得溶液中无Fe3+,则
a= ,混合粉末中铜的质量为 。
(2)若将固体完全溶解于1.00L上述硫酸中,测得c(Fe3+)=0.1mol/L(假设反应前后溶液的体积不变),则混合粉末中铜的质量的最大值为 g。
(3)若固体恰好完全溶解,消耗硫酸的体积为0.3L,且所得溶液中既有Fe3+,也有Fe2+,则 a 的取值范围是 。
高三第一次联考化学模拟试卷
参考答案
一、 二、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | A | D | B | A | D | D | D |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | AC | A | AC | D | AC | C | D | BD |
三、(本题包括2小题,共22分)
17答案: (10分) (1) A、B、D、F、G、J;泥三角、坩埚钳、干燥器
![]()
(2) 2 4
(4) 偏高; A、D、E
18答案:(12分)(1)(NH4)2CO3![]() 2NH3↑+CO2↑+H2O
2NH3↑+CO2↑+H2O
(2)碱石灰 因为另一种干燥剂的无水CaCl2,只能吸收水,不能吸收CO2,不能使氨气完全净化。
![]() (3)2Na2O2+2H2O
= 4NaOH+O2↑
(3)2Na2O2+2H2O
= 4NaOH+O2↑
(4)4NH3+5O2 4NO+6H2O放热,可以看到戊中铂丝比开始反应时更加红热
(5)己中的红棕色气体颜色变浅,因为当己浸入冰水中时,温度下降,红棕色的NO2
能转化成无色的N2O4,2NO2![]() N2O4+Q。降低温度时平衡向右移动,c(NO2)减小,c(N2O4)增大,所以颜色变浅。
N2O4+Q。降低温度时平衡向右移动,c(NO2)减小,c(N2O4)增大,所以颜色变浅。
四、(本题包括2小题,共18分)
19答案.(8分):⑴PbO2>KMnO4>H2O2 ⑵紫红色褪去,生成白色沉淀
⑶②2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H
③5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O(每空2分)
20答案: (10分)
![]() (1)
Fe2O3
(2) ①③④
(1)
Fe2O3
(2) ①③④
(3) Al(CH3)3 + 3H2O = 3CH4 ↑+ Al(OH)3 ↓ 2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
五、(本题包括1小题,共10分)
21答案:(10分)(1)HClO4 (2分)(2)![]() (2分)a b d(2分)(3)①90%(2分)②SO2+2HClO3=H2SO4+2ClO2(2分)
(2分)a b d(2分)(3)①90%(2分)②SO2+2HClO3=H2SO4+2ClO2(2分)
六、(本题包括2小题,共18分)
22答案(8分) (1)氮 钠(2分) (2)![]() (2分) (3)
(2分) (3)![]()
![]()
23答案(10分)、(1)①② (3分)
(2)①Al作负极, Al –
3e – Al3+。铜
②铜作负极, 2NO3 – + 2e – + 4H + 2NO2↑+ 2H2O。Al (7分)
七、(本题包括2小题,共18分)
24答案(8分):(1)20%(3分)(2)后者大 (2分) (3)0.29V(3分)
25答案:(10分)(1) 22.4(2分) 6.4g (2分)(2)18.1(3分) 16<a<22.4 (3分)