高三化学实验班复习测试试题
第I卷(选择题50分)
可能用到的相对原子质量:
H: 1 N:14 C:12 O:16 F:19 Na:23 S:32 Fe:56
Si:28 Cl:35.5 K:39 Cu:64 Br:80 Ag:108 I:127
一、选择题(每小题只有一个正确选项,)
1.“抓好资源节约,建设环境友好型社会”,是我国社会和经济长期发展的重要保证。你认为下列做法与之不相符的是
A.推广使用乙醇汽油作汽车燃料
B.研制开发以水代替有机溶剂的化工涂料
C.农村大力发展沼气,将废弃的秸杆转化为清洁高效的能源。
D.包装盒、快餐盒等全部用聚苯乙烯生产,以减少木材的使用
2.一定量的锎(252 98Cf)是有用的中子源,1 mg (252 98Cf)每秒约放出2.34×199个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关锎的说法错误的是
A.(252 98Cf)原子中,中子数为154 B.(252 98Cf)原子中,质子数为98
C.(252 98Cf)原子中,电子数为98 D.锎元素的相对原子质量为252
3.氧可与许多元素形成化合物,下列有关叙述错误的是
A.水分子的结构式为
B.氧与氟形成的化合物(OF2)中,氧元素的化合价为-2价
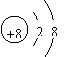 C.Na2O2的电子式为Na+
Na+
C.Na2O2的电子式为Na+
Na+
D.在MgO晶体中,O2-的结构示意图可表示为
4. 已知亚磷酸(H3PO3)只能生成两种钠盐(NaH2PO3和Na2HPO3),由此可知不正确的说法是
A 亚磷酸中磷呈+3价 B 亚磷酸有氧化性和还原性
C 亚磷酸是二元酸 D 亚磷酸只形成两种酸式盐而无正盐
5.实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是
A.1000mL,212g B.950mL,543.4g
C.任意规格,572g D.500mL,286g
6.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是
A.2.24 L CO2中含有的原子数为0.3×6.02×1023
B.0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023
C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023
D.4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023
7. 等温下,在两相同密闭容器甲、乙中分别加入1gSO2 、1gO2 和2gSO2 、2gO2 。下列叙述错误的是( )
A、化学反应速率:乙>甲 B、平衡后O2的浓度:乙>甲
C、SO2转化率:乙>甲 D、平衡后SO2的体积分数:乙>甲
8、物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液 由于浓度不同而能发生不同氧化还原反应的是
A.①③ B.③④ C.①② D.①③④
9.下列离子方程式书写正确的是
A.过量的SO2通入NaOH溶液中:SO2+2OH- = SO32 -+H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I- = 2Fe2++I2
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4- +5NO2- +6H+
= 2Mn2++5NO3- +3H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3- +Ba2++2OH- = BaCO3↓+2H2O+CO32 -
10.用固体NaOH配制物质的量浓度溶液时,下列操作会导致溶液浓度偏高的是
A.在烧杯中溶解时,有少量液体溅出
B.定容后,轻轻振荡、摇匀、静置,液面下降再加水至刻度
C.容量瓶使用前未干燥 D.定容时俯视容量瓶刻度线
11.为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是
A.Na2SO3溶液(BaCl2) B.FeCl2溶液(KSCN)
C.KI(淀粉溶液) D.HCHO溶液(石蕊试液)
12.设NA为阿伏加德罗常数,下列叙述中正确的是
A.常温下11.2 L的甲烷气体含有甲烷分子数为0.5NA个
B.14 g乙烯和丙烯的混合物中总原子数为3NA个
C.0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1NA个
D.5.6 g铁与足量的稀硫酸反应失去电子数为0.3NA个
13.下列叙述中正确的是
A.相同条件下,N2和O3混合气与等体积的N2所含原子数相等
B.等物质的量的甲基(—CH3)和羟基(—OH)所含电子数相等
C.常温常压下28 g CO与22.4 L O2所含分子数相等
D.16g CH4与18 g NH4+ 所含质子数相等
14.下列反应的离子方程式书写正确的是
A.浓烧碱溶液中加入铝片:Al+2OH- = AlO2- +H2↑
B.以石墨作电极电解氯化铝溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+ = 2Fe3++2H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42 -+Ba2++2OH- = BaSO4↓+2H2O
二、(每小题有一个或两个选项符合题意,)
15. 接触法制硫酸通常在400~500℃、常压和催化剂的作用下,用SO2与过量的O2反应生成SO3。 2SO2(g) + O2(g) ![]() 2SO3(g) ;
2SO3(g) ;
△H < O 在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件制SO3,采取加压措施的目的是
A.发达国家电能过量,以此消耗大量能源
B.高压将使平衡向正反应方向移动,有利于进一步提高SO2的转化率
C.加压可使SO2全部转化为SO3,消除SO2对空气的污染
D.高压有利于加快反应速率,可以提高生产效率
16. 某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大
B. 平衡不发生移动 C. 平衡向正反应方向移动
D. 物质C的质量分数增大
 17.右图是10mLpH均为2的盐酸和醋酸分别与足量的碳酸钙反应
17.右图是10mLpH均为2的盐酸和醋酸分别与足量的碳酸钙反应
一段时间后,所观察到的实验现象(反应过程中产生的气体收集
在试管上部的气球中)。下列说法正确的是
A.甲试管中盛放的是盐酸溶液
B.甲试管中盛放的是醋酸溶液
C.图中所示的反应瞬间,甲试管中溶液的pH小于乙试管中溶液的pH
D.图中所示的反应瞬间,甲试管中溶液的pH大于乙试管中溶液的pH
18. 一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下2AtI+2Zn==ZnI2+ZnAt2 AtI+2NH3(1)==NH4I+NH2At 则下列叙述正确的是
A.ZnI2既是氧化产物,又是还原产物
B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂又是还原剂
D.AtI与液氨反应,是自身氧化还原反应
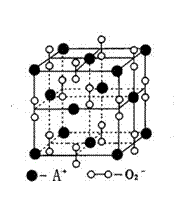 19.某离子晶体的晶体结构示意图如右图,晶体中氧的化合价可看作部分为0价,部分为-2价。则下列说法错误的是
19.某离子晶体的晶体结构示意图如右图,晶体中氧的化合价可看作部分为0价,部分为-2价。则下列说法错误的是
A、晶体中与每个A+距离最近的A+有12个
B、晶体中,阴离子与阳离子个数之比为1:1
C、该离子晶体化学式为A2O2
D、晶体中,0价氧原子与-2价氧原子的数目比为3:1
 20.2005年1月14日,成功登陆“土卫六”的“惠更斯”号探测器发回了350张照片和大量数据。分析指出,土卫六“酷似地球经常下雨”,不过“雨”的成份是液态甲烷。下列关于土卫六的说法中,不正确的是
20.2005年1月14日,成功登陆“土卫六”的“惠更斯”号探测器发回了350张照片和大量数据。分析指出,土卫六“酷似地球经常下雨”,不过“雨”的成份是液态甲烷。下列关于土卫六的说法中,不正确的是
A.土卫六上存在有机分子 B.地表温度极高
C.地貌形成与液态甲烷冲刷有关 D.土卫六上形成了甲烷的气液循环系统
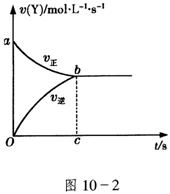
21.在容积固定为2L密闭容器中,充入X、Y各2mol发生可逆反应:X(g)+2Y(g)![]() 2Zg达到平衡,以Y的浓度改变表示的化学反应速率v(正)、v(逆)与时间的关系如10-2图,则Y的平衡浓度的表达式正确的是(式中S指对应区域的面积)( )
2Zg达到平衡,以Y的浓度改变表示的化学反应速率v(正)、v(逆)与时间的关系如10-2图,则Y的平衡浓度的表达式正确的是(式中S指对应区域的面积)( )
A.2-Saob B.1-Saob C.2-Sabco D.1-Sboc
22 在一定温度下,反应2HBr(g) ![]() H2(g)+Br2(g) △H >O
H2(g)+Br2(g) △H >O
达到平衡时,要使混合气体颜色加深,可采取的方法是
A. 减小压强 B. 缩小体积 C. 降低温度 D. 增大氢气浓
23.某温度下,将2molA和3molB充入一密闭容器中,发生反应:aA(g)+B(g) ![]() C(g)+D(g),5分钟后达到平衡。已知各物质的平衡浓度的关系为[A]a[B]=[C][D],若在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
C(g)+D(g),5分钟后达到平衡。已知各物质的平衡浓度的关系为[A]a[B]=[C][D],若在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
A. 60% B. 24% C. 4% D. 40%
24.下列事实不能用勒沙特列原理解释的是:
A.向饱和的胆矾溶液中加入一些无水硫酸铜粉末,很快有较多量的蓝色晶体形成
B.钢铁在潮湿的空气中容易生锈
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率。
25. 在一恒定的容器中充入2molA和1molB发生反应:2A(气)+B(气)![]() xC(气),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol 、C:1.4mol 充入容器,达到平衡后,C的体积分数仍为W%,则x值为( )
xC(气),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol 、C:1.4mol 充入容器,达到平衡后,C的体积分数仍为W%,则x值为( )
A、只能为2 B、只能为3
C、可能是2,也可能是3 D、无法确定
第Ⅱ卷(非选择题50分)
三、填空题
26、(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是 。
27.(8分)X、Y、Z、W是原子序数依次增大的短周期元素(稀有气体除外),其中两种为金属元素。X原子的原子半径是短周期元素中原子半径最大的,Y的单质可与浓NaOH溶液反应,X原子与Z原子最外层电子数之和为7。请回答下列问题:
(1) X和W形成的化合物的晶体类型为_______________
(2) Z的氢化物的相对分子质量与H2O2的相对分子质量相等,但其沸点却低于H2O2的沸点,理由是___________________________
(3) Y的单质与浓NaOH溶液反应的离子方程式是
(4) 0.1molW的单质与50mL1.5mol/L 的FeBr2溶液完全反应,则反应中被氧化的Fe2+和Br-的物质的量之比是____________写出该反应
的离子方程式
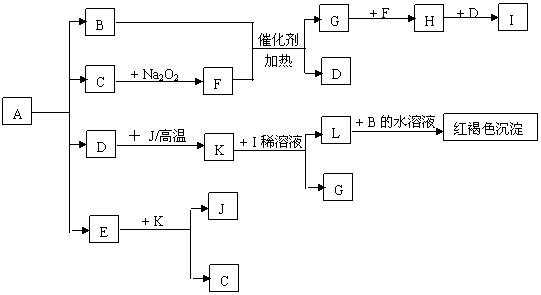 28.(10分)将一定量的晶体A,隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体。这四种物质与其他的相互转化关系如下图所示,J是一种常见的金属单质,C是一种非极性分子。图中部分反应条件及生成物没有列出。
28.(10分)将一定量的晶体A,隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体。这四种物质与其他的相互转化关系如下图所示,J是一种常见的金属单质,C是一种非极性分子。图中部分反应条件及生成物没有列出。
请按要求填空:
(1) 单质J的化学式_____________,E的分子式是______________
(2) 写出B和F反应的化学方程式______________________________
(3) 写出K和I的稀溶液反应的离子方程式
(4) A的化学式为______________________________
29.(6分)元素周期表是20世纪科学技术发展的重要理论依据之一,是我们学习化学的重要工具。假设NH4+是“元素”NH4的阳离子,则“元素” NH4在周期表中的位置应该是第 周期第 族;“元素” NH4的单质常温常压下应为 (填“固”、“液”或“气”)体;熔点 (填“高”或“低”) ; (填“能”或“不能”)导电;NH4的碳酸盐应 (填“易”或“不易”)溶于水。
30.(6分)氯、溴、碘同属于周期表中的VII A族,在上个世纪,人们很早就制得高碘酸及其盐,但得不到含+7价溴的化合物,1968年,化学家用发现不久的XeF2和KBrO3首先制得纯净的KBrO4晶体。
(1)高碘酸盐(IO65-)能在酸性条件下将Mn2+氧化为MnO4-(本身被还原成I03-),其反应平稳而迅速,写出该反应离子反应方程式:
(2)在25℃,已知pH=2的高碘酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01 mol/L的碘酸或高锰酸溶液与pH=12的NaOH
溶液等体积混合,所得混合液显中性。则高碘酸是 ;高锰酸是
(填“强酸”或“弱酸”)。
(3)写出XeF2和含KOH、KBrO3的水溶液反应得到KBrO4的离子方程式
31. (6分)化合物A含硫(每个分子只含一个硫原子)、氧以及一种或几种卤素;少量A与水反应可完全水解而不被氧化或还原,所有反应产物均可溶于水;将A配成水溶液稀释后分成几份,分别加入一系列0.1mol/L的试剂,现象如下:
①加入硝酸和硝酸银,产生白色沉淀 ;
②加入氯化钡溶液,无沉淀生成;
③溶液经酸化后加入高锰酸钾溶液,紫色褪去,再加入硝酸钡溶液,产生白色沉淀;
(1)由此判断组成该化合物的元素中,可能存在的卤有 ,A与水反应后生成的溶液中含有的离子可
能有 。
(2)要确定该化合物的分子式,称取11.90g A溶于水稀释至250.0mL,取25.00mL溶液加入足量的高锰酸钾溶液和硝酸钡溶液,使沉淀完全,
沉淀经洗涤、干燥后称重,为2.33g,试确定A的化学式
四、计算题(5分)
32. 6.4克铜与过量硝酸(a mol/L ,30mL)充分反应,硝酸的还原产物只有NO2、NO,反应后溶液中含H+为0.1mol。
(1)此时溶液中所含NO3-为 mol
(2)求生成的气体中NO2和NO的物质的量各分别为 mol
mol (用含有a的式子表示)
1、D 2、D 3、B 4、D 5、A、 6、D 7、D 8、A 9、C 10、D 11、A
12、B 13、B 14、C 15、BD 16、CD 17、BC 18、B 19、C
20、B 21、B 22、B 23、D 24、B 25、C
26、(12分)
(1)14HNO3+3Cu2O→6Cu(NO3)2+2NO↑+7H2O
(2)酸性 氧化性
(3)0.6mol
(4)使用了较浓的硝酸,产物中有部分二氧化氮生成
27、(1) 离子晶体
(2) H2O2分子间可以形成氢键,从而导致其沸点升高
(3) 2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
(4) 3:5
28、(1) Fe CO
(2) 4NH3 + 5O2 ![]() 4NO
+ 6H2O
4NO
+ 6H2O
(3) 3Fe3O4 + 28H+ + NO3- = 9Fe3+ + NO↑+ 14H2O
(4) NH4HC2O4
29、第三周期第IA族 ; 低 ; 固 ; 能 ; 易
30.(6分)
(1)离子反应方程式:5IO65-+2Mn2++14H+=5IO3-+2MnO4-+7H2O。(2分)
(2)高碘酸是弱酸(1分);高锰酸是强酸(1分)
(3)离子方程式: XeF2 + 2OH- + BrO3- =BrO4- + Xe + 2F- + H2O。(2分)
31.(1)可能存在的卤素有F、Cl …………2分(全对才给分)
溶液中含有的离子可能有H+、SO32—、HSO3—、Cl—、F—……2分(全对才给分)
(2)在25.00 mL溶液中产生n(BaSO4)=0.01mol,
则n(SO42-)=0.01mol …… 1分
原A中n(S)=0.1mol, n (A) =n (S)=0.1mol,
M (A)=11.90g/ 0.1mol=119g/mol, …………1分
由于S元素在A中的化合价为+4价,且A中只含一个S原子,故A中只能含有一个氧原子和两个卤原子 …………1分
又A的相对分子质量为119,故两个卤原子的相对原子质量和为:119-32-16=71 所以,只能是两个氯原子 …………1分
A的化学式为SOCl2…………2分
32.(12分)
⑴ 0.3 (6分)
⑵ n(NO)= 0.045a-0.55 n(NO2)=0.025-0.015a