高三化学![]()
 物质结构各氧族元素考试试卷
物质结构各氧族元素考试试卷
(物质结构和氧族元素) 命题人:李新朵
一、选择题(本题包括8小题,每小题6分,共48分,每小题只有一个正确答案)
6.已知原子![]() X,则下列论断正确的是(
)
X,则下列论断正确的是(
)
A.这种元素的近似原子量为m B.这种元素的原子量为m+n
C.该原子核内的中子数为n-m D.不能由此确定元素X的原子量
7.根据元素周期表判断,下列叙述中正确的是( )
A.第三周期元素形成的离子半径从左到右逐渐增大
B.所含元素种类超过18种的周期是四、五、六、七周期
C.ⅦA族元素的氢化物中,稳定性最好的其沸点也最高
D.周期表中最活泼的非金属元素位于第15纵行,最高价氧化物对应水化物酸性最强
8.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是( )
A.X与W可以形成W2X、W2X2两种化合物
B.Y元素最高价氧化物对应水化物的化学式为H2YO4
C.原子序数由小到大的顺序为W<X<Y<Z
D.Y、Z两元素的简单离子的半径Y>Z
9.下列叙述中,结论(事实)和对应的解释(事实)均不正确的是( )
A.金刚石的熔沸点高于晶体硅,因为C一C键能大于Si一Si键能
B.稀有气体的晶体属于原子晶体,因为其组成微粒是原子,不存在分子间作用力
C.二氧化硅晶体中不存在简单的SiO2分子,因为其晶体是含有硅氧四面体的空间网状结构
D.分子空间构型为正四面体结构的分子中化学键的键角可能是109028’,还可能为60°
10.对以下事实解释错误的是( )
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓H2SO4和铜片加热既表现出酸性,又表现出强氧化性
C.浓硫酸加热时可与木炭反应,还原产物是CO2、SO2
D.反应CuSO4+H2S==CuS↓+H2SO4能进行,说明CuS既不溶于水,也不溶于稀硫酸
11.下列叙述正确的是( )
①标准状况下,1molSO2和1molSO3具有相同的体积;②SO2使溴水、高锰酸钾酸性溶液褪色是因为SO2有漂白性;③SO2有漂白性,湿润的氯气也有漂白性,若将SO2和Cl2以等物质的量混合后通入品红溶液中,一定褪色更快;④SO2溶于水,得到的溶液有氧化性,还有还原性;⑤SO2通入Ba(OH)2溶液中,有白色沉淀生成,加入稀硝酸最终沉淀将全部溶解⑥SO2通入BaCl2溶液中无沉淀生成。
A.①② B.③⑤ C.④⑥ D.①③⑥
12.下列实验报告记录的实验现象正确的是( )
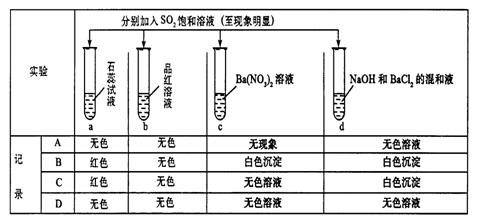 |
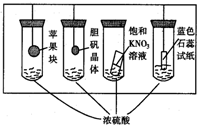 13.在下图所示的实验装置中,实验进行一段时间后,对观察到的现象叙述不正确的是( )
13.在下图所示的实验装置中,实验进行一段时间后,对观察到的现象叙述不正确的是( )
A.苹果块会干瘪
B.胆矾晶体表面有“白斑”
C.小试管内有KNO3晶体析出
D.蓝色石蕊试纸变红
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 |
二、(本题包括包括4小题,共60分)
26.(14分) (1)粉笔的粉末是教室里空气的主要污染源之一,粉笔的主要成分是生石膏
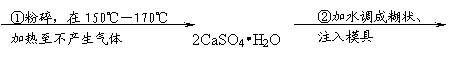 (CaSO4•2H2O),生产过程如下图:
(CaSO4•2H2O),生产过程如下图:
石膏砂 熟石膏 粉笔
回答:
①由熟石膏变成生石膏发生了 变化(选物理、化学)。
②生石膏与熟石膏的组成主要区别在于:
③步骤②中发生的化学方程式是:
④在熟石膏中加入甘油和纯碱可制成“无尘粉笔”,加入甘油是减少粉尘。加入纯碱可提高粉笔的硬度,加入纯碱发生反应的化学方程式是:
⑤有人设想,将无尘粉笔灰回收再制成熟石膏,你认为此法是否经济可行? 。
(2)2004年11月上旬,新疆硫磺沟火区的煤田大火在燃烧了100多年后被扑灭。扑灭煤田深处大火主要采用钻孔、注水、灌浆和表面覆盖泥土等方法。当水注入到高温燃烧的煤上时,发生的化学反应的方程式为: 。
煤是宝贵的化工燃料,在工业上,用碳在高温下还原二氧化硅可制得粗硅的化学反应方程式为: ________________________ 。
27.(16分)归纳整理是科学学习的重要方法之一。在学习了元素周期表之后,有关氧族元素的各种性质,可归纳整理出如下表所示的表格(部分)。
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据上表回答下列问题:
(1)硒的熔点范围可能是 _______________
(2)碲的化合价可能有 ________________
(3)硫、硒,碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式)。
(4)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为________________________________________________。
 (5)工业上Al2Te3可用来制备H2Te,完成下列化学方程
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方程
式:____A12Te3 + ( )== A1(OH)3↓ + H2Te↑
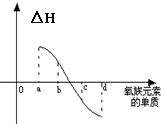
(6)右图所示为氧族元素单质与H2反应过程中的能量变化示意 图,其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应过程中的能量变化(反应的热效应)。则:b代表 ,d代表 (均写单质名称)。
28.(10分) 某化学兴趣小组利用下图I探究铜和浓H2SO4 反应生成气体的性质,图II用来收集多瓶SO2 气体,请回答下列问题。
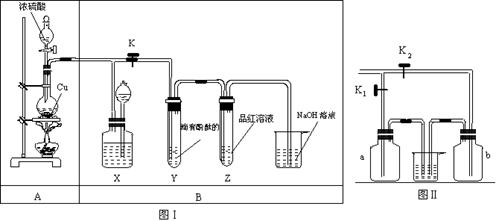
(1) 装置A中发生反应的化学方程式为 ________ ;
(2) 分液漏斗中盛有液体,但打开分液漏斗的活塞时液体不能顺利流下,可能的原因是
。
(3) 装置X的作用是贮存气体,X中广口瓶内应盛放的液体最好是 ;
① Na2CO3 溶液 ② 酸性高锰酸钾 ③ Na2SO3 溶液 ④ 饱和NaHSO3 溶液
(4) 装置Y、Z 中产生的现象相同,但原因不同,Y 中是由于(写离子方程式)
而Z中则是由于SO2 具有 。
(5)实验需要收集多瓶二氧化硫气体,在更换集气瓶时,为了减少二氧化硫逸散到空气中,将图I中的B部分更换为图II所示装置,可以用a、b 集气瓶交替收集二氧化硫气体,请回答:
① 检查集气瓶b 是否漏气的方法是
。
② 若只用集气瓶a 收集气体,在装置气密性良好,并加入药品后,准备制备并收集二氧化硫气体,下一步的操作是 ;
(6) ① 若用A装置作为实验室制取乙烯的发生装置,应对A装置作何改进?
② 烧瓶中应加入碎瓷片,目的是 。
③ 写出实验室制取乙烯的化学方程式 。
29.(15分)X、Y、Z为三种短周期元素,核电荷数依次增大,且X、Y、Z三种元素的原子核外电子层数之和为5。已知X是原子结构最简单的元素,Y元素原子最外电子层上的电子数是其电子层数的2倍,Z元素是植物生长的重要营养元素。请回答下列问题:
(1)推断X、Y、Z的元素:X ,Y ,Z (写元素符号)。
(2)Y元素的单质中有一种称为足球烯的分子Y60,它可能最易发生的反应是 。
A.消去反应 B.取代反应 C.加成反应 D.聚合反应
(3)最近科学家们合成了由Z元素形成的Z5n+,电子式为![]() 则n值为 。
则n值为 。
(4)Z与X可形成多种化合物,其中ZX3的结构式 ,Z2X4的电子式 。(用判断出的X,Y,Z的元素符号表示)
(5)Z的最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。
①甲的浓溶液与Y元素的单质共热的化学反应方程式为 。
②丙对水的电离起 作用(填“抑制”、“促进”或“不影响”),原因是(用离子方程式表示) ________________ ;
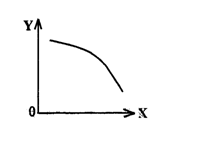 ③在一定条件下,将乙放入固定容积的密闭容器中使其发生分解反应,已知△H>0,达到平衡状态后,改变其中一个条件X,Y随X的变化符合图中曲线的是
(选填字母)
③在一定条件下,将乙放入固定容积的密闭容器中使其发生分解反应,已知△H>0,达到平衡状态后,改变其中一个条件X,Y随X的变化符合图中曲线的是
(选填字母)
a.当X表示温度时,Y表示乙的物质的量
b.当X表示压强时,Y表示乙的转化率
c.当X表示反应时间时,Y表示混合气体
|
(6)若X的单质的燃烧热为M kJ·mol-1,试写出其单 质在空气中燃烧的热化学方程式:
。
高三化学![]()
 物质结构各氧族元素考试试卷
物质结构各氧族元素考试试卷
高三化学参考答案及评分建议(物质结构和氧族元素) 命题人:李新朵
一、选择题(本题包括8小题,每小题6分,共48分,每小题只有一个正确答案)
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | D | C | A | B | C | C | B | D |
二、(本题包括包括4小题,共60分)
26.(每空2分,共14分) ①化学 (2分) ②晶体中结晶水的数量不同 (2分)
③2CaSO4.H2O + 3H2O = 2(CaSO4·2H2O) (2分)
④CaSO4+Na2CO3=CaCO3+Na2SO4 (2分) ⑤不可行 (2分)
(2) C
+ H2O ![]() CO + H2 (2分) SiO2+2C
CO + H2 (2分) SiO2+2C![]() Si+2CO↑ (2分)
Si+2CO↑ (2分)
27.(每空2分,共16分)(1)(113℃ ,450℃);
(2)-2、+4、+6; (3)H2Te>H2Se>H2S;
(4)还原性 2H2Se + O2 == 2H2O + 2Se;
(5)1 A12Te3 + 6 (H2O)== 2 A1(OH)3↓ + 3 H2Te↑
(6)硒 氧气
28.(共15分) (1) Cu +2H2SO4
![]() CuSO4 + 2H2O + SO2
↑ (2分)
CuSO4 + 2H2O + SO2
↑ (2分)
(2)分液漏斗上口的塞子未打开(或漏斗未与大气相通或漏斗塞子的凹槽未与颈部的通气孔对准(1分)
(3)④ (1分) (4)SO2 + OH- = HSO3- (2分) 漂白性(1分)
(5) ① 关闭K2,在烧杯中用水封住玻璃导管口,用手捂住集气瓶b,烧杯中导管口有气泡产生,松手后,导管内有一段液柱保持不降则气密性好(2分)
② 打开K1,关闭K2,点燃酒精灯。 (2分)
(6)① 将分液漏斗换成量程不低于200℃的温度计(1分) ② 防止暴沸(1分)
③ ![]() (2分)
(2分)
29.(共15分) (1)H C N(每个1分,共3分)
(2)C (1分) (3)1(1分)
![]()
![]() (5)①C+4HNO3(浓)
(5)①C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O ②促进
NH4++H2O NH3·H2O+H+
CO2↑+4NO2↑+2H2O ②促进
NH4++H2O NH3·H2O+H+
③ a
(6)2H2(g)+O2(g)==2H2O(l);⊿H = -2M kJ/mol