高三年级化学上册教学调研测试试卷
出卷人:周存军
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 P 31 S 32 Cl 35.5 K 39 Ca 40 Fe 56 Cu 64 Br 80
第Ⅰ卷 选择题(共56分)
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.近两年我省连发化学品爆炸事故。一座化工厂仓库着火是在搬运桶装亚氯酸钠的过程中引起的;另一起化工厂的爆炸事件是由于仓库渗水,金属镁粉接触水后起火,并随后引燃废料房内的废油引发的。据此,下列说法正确的是
A.亚氯酸钠属于易燃易爆的物质,搬运时应轻装轻卸,切勿猛烈撞击
B.上述两起火灾都可以用水或沙土扑灭
C.金属镁活性强,故在实验室镁条要密封保存
D.由于镁粉与石油不能直接反应,故可以放在一起保存
2.下列各溶液中,各离子可能大量共存的有
A.含有大量Ba2+的溶液中:HCO3-、Fe3+、Ag+、SO42-、SCN-
B.由水电离的c(OH-)=10-14mol·L-1 的溶液中:CH3COO-、 C6H5O-、Na+、K+
C.滴加无色酚酞试液后仍无色的溶液中:Na+、CO32-、K+、ClO-、AlO2-
D.加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、S2-
3.设NA表示阿伏加德罗常数,下列说法不正确的是
A.1 mol烷烃(CnH2n+2)含(2n+1)NA个共价键
B.1 mol石墨中含有NA/2个六碳环
C.常温常压下,31 g白磷与红磷混合物,含有NA个磷原子
D.将1 molNO2气体进行压缩,压缩后气体的分子数将少于NA
4.实验室用质量分数为98%、密度为1.84g·cm—3的浓硫酸配制100g 10%H2SO4溶液。配制过程中需要用到的仪器有:
①托盘天平 ②10mL量筒 ③100mL量筒 ④烧杯
⑤玻璃棒 ⑥100mL容量瓶 ⑦胶头滴管
A.①④⑤⑥⑦ B.②④⑤⑥⑦ C.②③④⑤⑦ D.②③④⑤⑥⑦
5.以水为溶剂进行中和滴定的原理是:H3O++OH— 2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也能发生自电离:2SO2 ![]() SO
SO![]() +SO2+;△H>0。下列叙述中,错误的是 ( )
+SO2+;△H>0。下列叙述中,错误的是 ( )
A.若以液态SO2为溶剂,用SOCl2滴定Na2SO3,该滴定反应可以表示为:
SO![]() +SO2+
+SO2+ 2SO2
B.在一定温度下,液态SO2中c(SO![]() )与c(SO2+)的乘积是一个常数
)与c(SO2+)的乘积是一个常数
C.液态SO2中自电离的存在,说明SO2是离子化合物
D.适当升高温度,液态SO2的导电能力增强
6.下列有关实验的叙述中,不正确的有
①蒸干AlCl3溶液可得纯净的无水氯化铝;②试管里加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现;③无法用分液漏斗将甘油和水的混合液体分离;④用酸式滴定管量取20.00mL高锰酸钾酸性溶液;⑤为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比;⑥苯与溴水在铁粉的催化作用下制备溴苯;⑦配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止;⑧在苯酚溶液中滴入少量稀溴水溶液中立即出现白色沉淀。
A.4句 B.5句 C.6句 D.7句
7. 下列操作中,溶液的颜色不发生变化的是 ( )
A.氯化铁溶液中加入还原性铁粉 B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液 D. 碳酸氢钠溶液中滴加稀盐酸
8.R、M、T、G、J为原子序数依次递增的同一周期主族元素,下列说法一定正确的是(m、n均为正整数)
A.若M(OH)n+1为强碱,则R(OH)n也为强碱
B.若HnJOm为强酸,则G是位于ⅤA以后的活泼非金属元素
C.若T的最低化合价为-3,则J的最高正化合价为+6
D.若M的最高正化合价为+4,则五种元素都是非金属元素
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
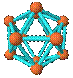
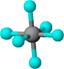
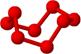
9.观察下列模型并结合有关信息,判断有关说法不正确的是
| B12结构单元 | SF6分子 | S8分子 | HCN | |
| 结构模型示意图 |
|
|
|
|
| 备注 | 熔点1873K | / | 易溶于CS2 | / |
A.单质B12属原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.SF6是由极性键构成的非极性分子
C.固态硫S8属于原子晶体
D.HCN的结构式为H-C≡N
10.钡在氧气中燃烧时的得到一种钡的氧化物晶体,结构如下图所示,有关说法正确的是
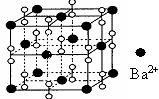 A.该晶体属于离子晶体
A.该晶体属于离子晶体
B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与CsCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有6个
11. 下列关于浓硝酸和浓硫酸的叙述正确的是( )。
A.都是常用的干燥剂
B.分别露置在空气中,容器内溶质的物质的量浓度都降低
C.都可以储存于铝制槽罐中
D.和铜反应中都只表现出强氧化性
12.已知HBrO比![]() 酸性弱,
酸性弱,![]() 比HBrO难电离,则下列反应不能发生的是( )
比HBrO难电离,则下列反应不能发生的是( )
A.![]()
B.![]()
C.![]()
D.![]()
13.下列离子方程式不正确的是
A.三氯化铝溶液中加入过量氨水:Al3++3OH―![]() Al(OH)3↓
Al(OH)3↓
B.4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合:
4AlO2―+7H++H2O![]() 3Al(OH)3↓+Al3+
3Al(OH)3↓+Al3+
C.在Mn2+的溶液中加入HNO3再加入PbO2,得紫红色溶液:
5PbO2+2Mn2++4H+![]() 5Pb2++2MnO4-+2H2O
5Pb2++2MnO4-+2H2O
D.将0.1mol/L盐酸数滴缓缓滴入0.1mol/L25mLNa2CO3溶液中,并不断搅拌:
2H++CO32-![]() CO2↑+H2O
CO2↑+H2O
14. 0.1mol/LKHSO4和0.1mol/LNa2S溶液等体积混合后,溶液能使pH试纸变蓝,则离子浓度关系正确的是( )
A [SO42-] > [HS-] > [OH-] > [H+]
B [Na+] > [K+] > [H+] > [OH-]
C [Na+]=[S2-]+[H2S]+[HS-]+[SO42-]
D [Na+]+[K+]+[H+]=[SO42-]+[S2-]+[HS-]+[OH-]
15. 被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品。截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义。其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如下图所示。有关该化合物的叙述正确的是( )
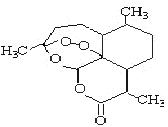
A.分子式为:C16H20O5
B.该化合物在一定条件下不能与NaOH溶液反应
C.青蒿素与维生素一样是水溶性的
D.该化合物中含有过氧键,一定条件下有氧化性
16.对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.52倍,
则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)
D.温度不变时,若压强增大至原来的2倍,达到新平衡时,总体积一定比原体积的1/2要小
第Ⅱ卷 非选择题(共64分)
三、(本题包括2小题,共14分)
17.(6分)C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Ge的原子核外电子排布式为
(2)按要求指出下列物质的成键方式、原子的杂化方式。
①C2H2分子碳碳之间的成键方式 ,C原子的杂化方式 。
②SiO2硅氧之间的成键方式 ,Si原子的杂化方式 。
(3)CO可以和很多金属形成配合物,如Ni (CO)4,Ni与CO之间的键型为
18.(8分)(1)多硫离子Sx2-(x是2-6整数)碱性溶液中被BrO3-氧化成SO42-,BrO3-自身被还原成Br-,该反应的离子方程式是
3Sx2-+6(x-1)OH-+(3x+1)BrO3- 3xSO42-+(3x+1)Br-+3(x-1)H2O
该反应中Sx2-作还原剂。每1mol Sx2-失去 mol电子。若通过测定BrO3-与OH-的用量情况来确定x的值,至少需要确定以下A—C中的 才能确定Sx2-中的x的值.
A.BrO3-或OH-的绝对用量 B.BrO3-与OH-的绝对用量
|
![]() (2)多硫化钠是一种重要的多硫化物,利用反应2Na+xS
Na2Sx在一定条件下制成的钠硫可逆电池是目前推广使用的一种新型高能电池,该电池工作时的正极反应是
,给该电池充电时,钠极反应与外电源的
极相连接。
(2)多硫化钠是一种重要的多硫化物,利用反应2Na+xS
Na2Sx在一定条件下制成的钠硫可逆电池是目前推广使用的一种新型高能电池,该电池工作时的正极反应是
,给该电池充电时,钠极反应与外电源的
极相连接。
四、(本题包括2小题,共18分)
19(10分)KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此精确配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸l h;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处:
(4)利用氧化还原滴定方法,在70℃-80℃条件下用基准试剂(纯度高、稳定性好的物质)溶液测定其浓度。回答下列问题:
(1)为什么要称取稍多于所需的KMnO4固体___________________________________
(2)如何保证在70℃~80℃条件下进行滴定操作:_______________________________
(3)若准确称取W g草酸晶体(H2C2O4·2H2O)溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。
6H++2MnO4-+5H2C2O4·2H2O====2Mn2++10CO2↑+18H2O
①滴定终点标志是_________ _________;
②KMnO4溶液的物质的量浓度为________________mol/L;
③若滴定前平视,滴定后俯视,则测得的浓度值将________(填“偏高”或“偏低”)
20.(8分)碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2
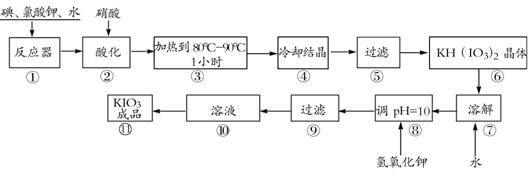
(1)步骤①反应器发生的反应中,转移电子总数为 ;
(2)步骤②中,用硝酸而不用HI,其原因可能是 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
五、(本题包括2小题,共18分)
21.(8分)A、B、C、D、E、F六种中学常见的物质,皆由短周期元素组成,有转化关系:
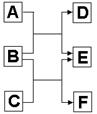 (1)若A、C、E皆为氧化物,且常温下A为无色液体,E为有毒气。B、D、F皆为非金属单质,且D为气体。则A的结构式为
, 1molC中含有
个共价键。
(1)若A、C、E皆为氧化物,且常温下A为无色液体,E为有毒气。B、D、F皆为非金属单质,且D为气体。则A的结构式为
, 1molC中含有
个共价键。
(2)若A、C、E皆为氢化物,三者皆为极性分子,其中C的相对分子质量最小;D、E、F皆为氧化物, 其中D、F为有毒气体。则
①A、C、E沸点由高到低的顺序为 (填化学式)。
②A跟D常温下反应可生成一种单质,化学方程式为 。
22.(10分)下面是有名的Diels-Alder反应的一个实例:
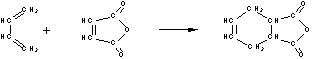
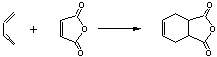 也可用下面相应的键线式表示:
也可用下面相应的键线式表示:
请认真分析上述变化,回答下列问题:
以某链烃A为起始原料合成化合物G的路径如下(图中Mr表示相对分子质量):
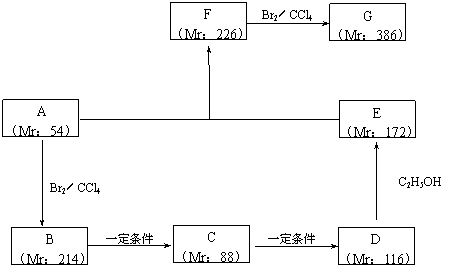
(1)指出反应类型:B→C : ,F→G : 。
(2)写出下列物质的结构简式:
A : ,F : 。
(3)写出下列反应的化学方程式:
B → C : ;
D → E : 。
 六、(本题包括2小题,共14分)
六、(本题包括2小题,共14分)
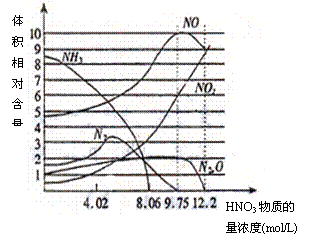
23.(6分)下图表示铁与不同浓度硝酸反应时,各种还原产物的相对含量与硝酸溶液浓度的关系,试回答:(1)浓度为9.75mol/L的HNO3溶液与少量金属铁反应时,得到混合气体的成分是 ,它们的体积比为 。
(2)将14.56g铁粉投入大量的9.75mol/LHNO3溶液中(因硝酸溶液大量,故其浓度维持不变),当铁粉完全溶解后收集到气体6.048L(标准状况),求反应中消耗HNO3的总物质的量。
24.(8分)氨气极易溶于水,人们把氨气溶于水后得到的 溶液称为氨水。
(1)将标准状况下11.2 L氨气溶于100 mL水中,得到密度为0.868 g/cm3的氨水。求所得氨水的物质的量浓度。
(2)将上述30 mL氨水与70 ml 2 mol/L的A1C13溶液混合,生成的沉淀质量为n g,求n值。
(3)若往上述(2)反应后未过滤的浊液中加入y mL 5 mol/L的NaOH溶液后,仍得到沉淀物质量为n g,求所加氢氧化钠溶液的最大体积。
高三年级化学答题卷
第Ⅰ卷 选择题(共56分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|
|
|
|
|
|
|
|
|
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
|
|
|
|
|
|
|
|
|
第Ⅱ卷 非选择题(共64分)
三、(本题包括2小题,共14分)
17.(6分)(1)
(2)① , 。
② , 。
(3)
18.(8分)(1)
(2) , 极。
四、(本题包括2小题,共18分)
19(10分)(1)___________________________________
(2)_______________________________
(3)①_________ _________;
②__________________:
③_____ ___(填“偏高”或偏低)
20.(8分)(1) ;
(2) ;
(3) ;
(4) 。
五、(本题包括2小题,共18分)
21.(8分)(1) , 。
(2) ① 。
② 。
22.(10分) (1) B→C : ,F→G : 。
(2) A : ,F : 。
(3) B → C : ;
D → E : 。
六、(本题包括2小题,共14分)
23.(6分)(1)混合气体的成分是 ,它们的体积比为 。
(2)
24.(8分)
高三年级化学答案
第Ⅰ卷 选择题(共56分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| A | B | A | C | C | B | D | A |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| C | A | BC | AD | AD | AC | D | C |
第Ⅱ卷 非选择题(共64分)
三、(本题包括2小题,共14分)
17.(6分)(1) 1s22s22p63s23p63d104s24p2
(2)① 共价键(或σ键与π键), ,sp杂化 。
② 共价键(或σ键), , sp3杂化 。
(3) 配位键 -(每空1分)
18.(8分)(1) 6x+2 , C
(2) xS+2e-=Sx2— , 负 极。 -(每空2分)
四、(本题包括2小题,共18分)
19(10分)(1)___有部分KMO4被还原成MnO(OH)2 (2分)_______________________
(2)______可在水浴中加热(2分)__________________
(3)①_____当最后滴下1滴KMnO4溶液后半分钟不褪色时(2分)__ ____;
②________ 10w/63V (2分)__________:
③④____偏高 (2分)_ ___
20.(8分)(1)60(2分)
(2)HI具有还原性,能将已生成的碘酸氢钾还原(2分)
(3)Cl2能将KIO3氧化成KIO4(2分)
(4)蒸发结晶(2分)
五、(本题包括2小题,共15分)
21.(8分)(1)H-O-H , 4NA (每空2分) 。
(2) ① H2O>NH3>H2S 。(每空2分)
② SO2 + 2H2S===2H2O + 3S↓ (未写↓不扣分) (2分) 。
22.(10分)(1)反应类型:B→C :取代反应(或水解反应),F→G :加成反应(各1分)。
(2)写出下列物质的结构简式:
A : CH2=CH-CH=CH2 ,F : ![]() (各2分)。
(各2分)。
(3)写出下列反应的化学方程式:
B → C :CH2Br-CH=CH-CH2Br+H2O![]()
HOCH2-CH=CH-CH2OH+2HBr(2分);
D
→ E :HOOC-CH=CH-COOH+2C2H5OH![]()
C2H5OOC-CH=CH-COOC2H5+2H2O (2分)。
六、(本题包括2小题,共14分)
23.(6分)(1)混合气体的成分是N2O,NO2,NO(2分),对两种得1分,有错不得分
它们的体积比为1: 3: 5(2分)。2:6:10(不扣分)
(2)解:n(气体)=6.048L÷22.4L/mol=0.270m
n(N2O)=0.270×1/9=0.0300mol…………………………………….…….….. n(NO2)=0.270×3/9=0.0900mol……………………………………………....
n(NO)=0.270×5/9=0.150mol……………………………………
被还原HNO3物质的量为:0.0300mol×2+0.0900mol+0.15omol=0.300mol…
生成Fe(NO3)3所消耗的HNO3的物质的量为:(14.56g÷56g/mol) ×3=0.780mol
所以,消耗HNO3的总物质的量为:0.300mol+0.780mol=1.08mol…………....
答:消耗HNO3的总物质的量为1.08mol (2分)
24.(8分)(1)氨水物质的量浓度。(2分) (4.00 mol.L-1不扣有效数字分)
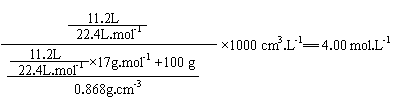
(2) (2分) Al3+ +3NH3.H2O = Al(OH)3↓ + 3NH4+
1mol 3mol 78 g
0.14mol 0.12mol x g
因0.14×3>0.12×1,Al3+过量,所以
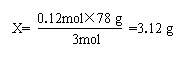
(3) 104mL(4分)