高三年级化学上册第三次月考题
化 学 试 题
考试时间120分钟,共150分
可能用到的相对原子量:H 1 He 4 C 12 N 14 O16 Na 23 Mg 24 Si 28
S 32 Cl 35.5 Cu 64 I 127 Ba 137 Ca – 40
第Ⅰ卷(选择题,共72分)
一、选择题(下列各题只有一个选项符合题意。每小题3分共72分)
1.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是 ( )
A.2.24LCO2中含有的原子数为0.3×6.02×1023
B.0.1L 3 mol·L-1的NH4NO3溶液中含有NH+4数目为0.3×6.02×1023
C.5.6g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023
D.4.5g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023
2.下列反应离子方程式正正确的是 ( )
A.向次氯酸钙溶液中通入二氧化硫:Ca2++2ClO+SO2+H2O = CaSO3↓+2HClO
![]() B.碳酸钠水解:CO2-3+2H2O H2CO3+2OH-
B.碳酸钠水解:CO2-3+2H2O H2CO3+2OH-
C.氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O
D.氧化铁粉末投入氢碘酸溶液中:Fe2O3+6HI=2Fe3++6I-+3H2O
3.若以μ表示水的摩质量,V表示在标准状况下水蒸气的摩尔体积,ρ为在标准状况下水蒸气的密度,NA为阿伏加德罗常数,m、△分别表示每个水分子的质量和体积,下面是四个关系式:①NA=![]() ②
②![]() ③
③![]() ④
④![]() 其中正确的是( )
其中正确的是( )
A.①② B.①③ C.③④ D.①④
4.在相同温度和压强下,4个容器中分别装有4种气体,已知容器中的气体和容器的容积分别是a.CO2,100mL;b.O2,200mL;c.N2,400mL;d.CH4,600mL,则4个容器中气体的质量由大到小的顺序是 ( )
A.a>b>c>d B.b>a>d>c C.c>d>b>a D.d>c>a>b
5.下列说法中正确的是(NA表示阿佛加德罗常数) ( )
A.1 mol MgCl2中含有的离子数为NA B.0.1 molOH-含NA个电子
C.1.8g重水(D2O)中含NA个中子 D.标准状况下11.2L臭氧中含NA个氧原子
6.已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验
①中产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KJ试纸上,试纸变蓝色;下列判断正确的是 ( )
A.上述实验证明氧化性:KMnO4>Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KJ试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
7.两份等体积、等浓度的NaOH溶液,分别与体积相等的MgCl2、AlCl3溶液混合,充分反应后,Mg2+、Al3+均恰好形成沉淀,则原MgCl2、AlCl3溶液中Cl-浓度之比为( )
A.1:1 B.1:2 C.2:3 D.3:2
8.在标准状况下,将体积为VL的A气体,溶于100.0mL水中,得到密度为ρg·cm-3的溶液,A气体的摩尔质量为Mg·mol-1,则此溶液的物质的量浓度为 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
9.KMnO4、KclO3、KClO均为强氧化剂,在实验室里可代替MnO2,与浓盐酸反应制备Cl2,已知反应:KclO3+HCl→KCl+Cl2↑+H2O(未配平),若用K35ClO3与H37Cl作用,则下列说法中正确的是 ( )
A.该反应中转移电子数为6e- B.KCl只含35Cl
C.生成的KCl中既含35Cl又含37Cl D.生成氯气的式量约为73.3
|
A.p(He)>p(H2)>p(O2) B.p(O2)>p(He)>p(H2)
C.p(H2)>p(O2)>p(He) D.p(H2)>p(He)>p(O2)
11.运用周期律分析下列推断,其中错误的是 ( )
A.已知Ba是第六周期IIA族的元素,故Ba(OH)2的碱性比Mg(OH)2的碱性强
B.已知As是第四周期VA族的元素,故AsH3的稳定性比NH3的稳定性强
C.已知Cs的原子半径比Na的原子半径大,故Cs与水反应比Na与水反应强烈
D.已知Cl的核电荷数比Al的核电荷数大,故Cl的原子半径比Al的原子半径小
12.向存在大量Na+、Cl-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离子组是
( )
A.K+、Br-、CO2-3 B.Al3+、H+、MnO-4
C.NH+4、Fe3+、SO2-4 D.Ag+、Cu2+、NO-3
13.若以ω1和ω2分别表示浓度为a mol·L-1和b mol·L-1硫酸的质量分数,且知2a = b,则下列推断正确的是 ( )
A.2ω1=ω2 B.2ω2=ω1 C.ω2<2ω1 D.ω1>ω2>2ω1
|
15.某温度下向100g澄清的饱和石灰水中加入5.6g生石灰,充分反应后恢复到原来的温度下,下列叙述正确的是 ( )
A.沉淀物的质量为5.6g B.沉淀物的质量为7.4g
C.饱和石灰水的质量大于98.2g D.饱和石灰水的质量小于98.2g
16.下列各溶液中能大量共存的离子组是 ( )
A.使紫色石蕊溶液呈红色的溶液中: Ag+、Mg2+、Br-、K+
B.使PH试纸呈红色的溶液中:Fe2+、I-、NO-3、Cl-
C.C(H+)=1×10-14mol/L的溶液中:Na+、AlO-2、F-、SO2-3
D.水电离出的C(H+)与C(OH-)乘积为10-28的溶液中K+、Na+、HCO-3、Ca2+
17.A元素的阴离子、B元素的阴离子和C元素的阳离子具有相同的电子层结构,已知A的原子序数大于B的原子序数,则三种离子半径大小的顺序是 ( )
A.rA>rB>rC B.rB>rA>rC C.rC>rA>rB D.rA>rC>rB
18.下列有关短周期元素的叙述中,肯定正确的是 ( )
A.原子最外层电子只有1个或2个的元素是金属元素
B.16号元素原子的最外层电子数是4号元素原子的最外层电子数的四倍
|
D.![]() C表示的碳原子核内有6个质子,7个中子
C表示的碳原子核内有6个质子,7个中子
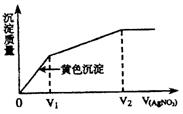
19.往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的
质量与加入AgNO3溶液体积的关系如图所示。则原
溶液中c(I-)/c(Cl-)的比值为 ( )
A.(V2-V1)/V1 B.V1/V2
C.V1/(V2-V1) D.V2/V1
20.AB3是短周期两种元素形成的化合物,已知B原子比A原子多一个电子层,且AB3分子中所有原子满足8电子结构,则下列说法正确的是 ( )
A.AB3是三氧化硫 B.A是IIIA族元素
C.B原子比A原子多12个电子 D.B的氢化物和A的氢化物都极易溶于水
21.Cl2在70℃的NaOH水溶液中,能同时发生两个自身氧化还原,反应完全后测得溶液中NaClO与NaClO3的物质的量之比为4:1,则溶液中NaCl与NaClO的物质的量之比为
( )
A.1:1 B.11:2 C.9:4 D.5:1
22.有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项m、n均为正整数)。下列说法正确的是 ( )
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
23.以下除杂方法(括号内为杂质)中,正确的是 ( )
①CH3COOH(H2O):加浓H2SO4,蒸馏 ②Cl2(HCl):饱和NaCl溶液 ③CO2(HCl):饱和Na2CO3溶液 ④KI(I2):酒精,分液⑤溴苯(溴):NaOH溶液,分液⑥FeCl3(FeCl2):铁屑
A.全部 B.①②③④⑥ C.①②⑤ D.只有②⑤
24.有一铁的氧化物样品,用140mL 5mol·L-1盐酸可恰好使其完全溶解。所得溶液可吸收标准状况下0.56L氯气,使其中的Fe2+全部转化为Fe3+。该样品可能的化学式为( )
A.Fe4O5 B.Fe5O7 C.Fe2O3 D.Fe3O4
|
二、填空题(共20分)
25.(10分)用A+、B-、C3+、D、E、F、G和H分别表示含有10个电子的八种微粒(离子或分子),请回答:
(1)A元素是 、B元素是 、C元素是 (用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是 。
(3)F是由两种元素组成的三原子分子,其分子式是 ,电子式是 。
(4)G分子中含有4个原子,其分子式是 。
(5)E是所有含10个电子微粒中反应活泼性最弱的分子,其分子式为 。
(6)写出一个电离方程,涉及到的微粒均为10个电子 。
26.(包括2个小题,每空2分,共10分)
(1)氰(CN)2、硫氰(SCN)2的化学性质与卤素(X2)很相似,化学性质上称为拟卤素,如(SCN)2+H2O = HSCN+HSNO。已知阴离子的还原性强弱为Cl<Br<CN<SCN<I-。试写出:
a)(CN)2与KOH溶液反应的化学方程式
b) NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式为
(2)向amolFeBr2的溶液中通入bmolCl2,当b/a的取值不同时,将发生不同的反应,请按要求写出有关的离子方程式。
a)b/a≤1/2时
b) b/a≥3/2时
c) b/a=1时
三、(本题包括2个小题,共24分)
|
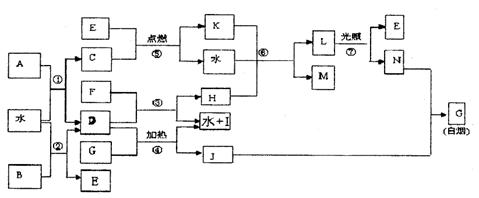
(1)G的电子式是 ;
(2)反应⑥的化学方程式是 ;
(3)反应⑤在空气中燃烧时的现象是 ,
已知C的燃烧是1300kJ/mol,表示C燃烧的热化学方程式
;
(4)根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是 。
28.(14分)下表列出了前20号元素中的某些元素性质的有关数据:
|
元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | — |
| 最低价态 | — | — | -2 | — | -4 | -3 | -1 | — | -3 | -1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填写编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式) 。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ;
(3)写出①的单质与③的单质在点燃条件下生成物的电子式 ,其所含化学键的类型是
(4)元素⑦与⑩相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
A.常温下元素⑦的单质的颜色比元素⑩的单质的颜色深
B.元素⑩的单质通入⑦的钠盐的水溶液中,不能置换出⑦的单质
C.元素⑦与元素⑩形成的化合物中元素⑦呈正价态
四、(本题包括2个小题,共27分)
29.(9分)欲配制500mL0.2mol·L-1的碳酸钠溶液,回答下列问题:
(1)通过计算,应用托盘天平称取 g碳酸钠粉末。
(2)若砝码和药品的位置放反了(假使称量时未使用烧杯,1g以下用游码),天平平衡时称量碳酸钠的质量是 g。
(3)现有托盘天平(带砝码)、烧杯、药匙、量筒、称量纸等实验用品,配制过程还需要的仪器有
(4)下列操作使所配溶液浓度偏高的是
①若称取28.6gNaCO3·10H2O进行配制;②称量时选用了生锈的砝码;③往容量瓶转移溶液时有少量的液体溅出;④碳酸钠中有不溶性杂质;⑤未洗涤溶解碳酸钠的烧杯;⑥定容时仰视刻度线;⑦容量瓶未干燥即用来配制溶液。
30.(18分)二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。②有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 | |||
| S | 112.8 | 444.6 | 略 | |||
| S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S;300℃以上完全
分解;S2Cl2+Cl2 2SCl2 |
|
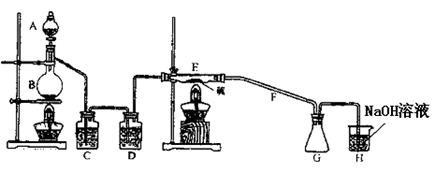
(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见
(2)利用改进后的正确装置进行实验,请回答下列问题:
B中反应的离子方程式: ;
E中反应的化学方程式: 。
(3)C、D中的试剂分别是 、 。
(4)仪器A、B的名称分别是 、 ,F的作用是 。
(5)如果在加热E时温度过高,对实验结果的影响是 ,在F中可能出现的现象是 。
(6)S2Cl2粗品中可能混有的杂质是(填写两种) 、 ,
为了提高S2Cl2的纯度,关键的操作是控制好温度和 。
五、计算题(本题一个小题,7分)
31.一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为
1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为多少?
(2)所得溶液中Cl-的物质的量为多少?
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)为多少?
参考答案
一、选择题(每小题3分共72分)
1.D 2.D 3.B 4.C 5.B 6.A 7.C 8.B 9.D
10.D 11.B 12.A 13.C 14.D 15.D 16.C 17.B 18.D
|
二、填空题(共20分)
25.(10分)(1)Na F O (2)HF (3)H2O (4)NH3 (5)Ne
![]() (6)2H2O H3O+
+OH-
(6)2H2O H3O+
+OH-
26.(包括2个小题,每空2分,共10分)
(1)(CN)2+KOH=KCN+KCNO 2SCN-+(CN)2=(SCN)2+2CN-
(2)a)2Fe2++Cl2=2Fe3++2Cl-
b)2Fe2++3Cl2+4Br-=2Fe3++6Cl-+2Br2
c)2Fe2++2Cl2+2Br-=2Fe3++4Cl-+Br2
三、(本题包括2个小题,共22分)
27.(10分)(1)略
(2)Ca(ClO)2+CO2+H2O= CaCO3↓+2HclO
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);△H=-1300kJ/mol
(3)CaO2
28.(12分)(1)② (2)CCl4 PCl3 第三周期,VIA族 (3)Fe
四、(本题包括2个小题,共28分)
29.(10分)(1)10.6 (2)9.4 (3)500ml容量瓶、胶头滴管、玻璃棒 (4)②
30.(18分)
(1)用导管将A的上口和B相连(或将A换成恒压滴液漏斗) (1分)
在G和H之间增加干燥装置 (2分)
(2)MnO2+4H++2Cl- === Mn2++Cl2↑+2H2O
2S+Cl2 S2Cl2 (各1分,共2分)
(3)饱和食盐水(或水) 浓硫酸 (各1分,共2分)
(4)分液漏斗 蒸馏烧瓶 导气、冷凝 (各1分,共2分)
(5)产率降低 (2分) 有固体产生(或其他正确描述)(2分)
(6)SCl2、Cl2、S(任写其中两种即可) (各1分,共2分)
控制浓盐酸的滴速不要过快 (1分)
五、计算题(本题一个小题,8分)
(1)10.71% (2)0.25mol (3)n(Cl2):n(H2) =3:2