高三毕业班化学上册第三次质量检查试题
化 学 试 题
考试时间:90分钟 试卷满分:110分
注意事项:
![]() 准考证号码填写说明:准考证号码共九位,每位都体现不同的分类,具体如下:
准考证号码填写说明:准考证号码共九位,每位都体现不同的分类,具体如下:
| 0 | 5 | 0 | 0 | 0 |
答题卡上科目栏内必须填涂考试科目
可能用到的相对原子质量: H—1 O—16 C—12 N—14 Na—23 Al—27 Mg—24 P—31
第Ⅰ卷 (选择题,共50分)
一、选择题(每题仅有一个选项符合题意,每题2分,共50分)
1.下列说法不符合人与自然和谐相处的是 ( )
A.对农作物合理施用化肥 B.将塑料垃圾埋入地下或倾倒入海
C.对废旧电池进行回收处理 D.使用沼气、太阳能、风能等代替煤
2.在下列反应中水既不是氧化剂,也不是还原剂的氧化还原反应是 ( )
A.氯气溶于水 B.金属钠溶于水
C.三氧化硫溶于水 D.氟气通入水中
3.在下列几种物质中,跟HCl溶液和NaOH溶液不是都能发生反应的是 ( )
A.NaHCO3 B.SiO2 C.(NH4)2CO3 D.Al(OH)3
4.下列有关氮气的叙述不正确的是:
A.氮分子为非极性分子
B.在灯泡中充入氮气可防止钨丝被氧化
C.氮元素比磷元素非金属性强,因而氮气比磷的化学性质活泼
D.液氮可作冷冻剂
 5.下列化学用语表达正确的是 ( )
5.下列化学用语表达正确的是 ( )
|
C.水的结构式 D.硫离子结构示意图
6.根据相关的化学原理,下列判断正确的是 ( )
A.由于水中存在氢键,所以稳定性:H2O>H2S
B.由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2 C.若A2 + 2D— == 2A— + D2,则氧化性D2>A2
D.若R2—和M+的电子层结构相同,则离子半径R2—>M+
7.下列化工生产中所发生的主要化学反应,不涉及氧化还原反应的是 ( )
A.制造普通玻璃 B.接触法制硫酸
C.工业冶炼铝 D.工业合成氨
8.下列物质中见光会分解的是 ( )
①HNO3 ②AgBr ③HClO ④H2O2 ⑤AgNO3
A.①④ B.①②⑤ C.②③④⑤ D.全部
9.三氯化氮(NCl3)在常温下是一种淡黄色液体,其分子呈三角锥形,以下关于NCl3的叙述正确的是 ( )
A.NCl3形成的晶体为原子晶体
B.分子中N-Cl键是非极性共价键
C.NCl3是一种含极性键的极性分子
D.N-Cl键能小,故NCl3沸点低
|
A.铁与硫反应生成硫化亚铁,而铁与氯气反应时生成氯化铁
B.与金属钠反应,氯原子得一个电子,而硫原子能得两个电子
C.常温时氯气呈气态,而硫呈现固态
D.氯的最高价为+7价,而硫的最高价为+6价
11.用NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.1.8g重水(D2O)中含有的中子数为NA
B.常温常压下,31g白磷含有NA个磷原子
![]() C.1mol 中含有电子数为16NA
C.1mol 中含有电子数为16NA
D.标准状况下,22.4L单质溴所含有的原子数目为2NA
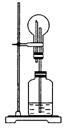
12.在右图所示的装置中,烧瓶中盛有空气,广口瓶中盛
放下列物质时不能发生喷泉的选项 是 ( )
A.纯碱和稀硫酸
B.NaOH固体和浓氨水
C.Na2O2和NaOH溶液
D.Cu与浓硫酸
13.某溶液中含有下列六种离子,①HCO3—、②SO32—、③Na+、④CO32—、⑤NH4+、⑥NO3—,向其中加入足量Na2O2后,溶液中离子浓度基本保持不变的是 ( )
A.①②④⑤ B.②③④ C.③④⑥ D.只有⑥
14.下列离子方程式,正确的是 ( )
A.Ca(ClO)2溶液中通入少量SO2气体:
H2O +SO2 + Ca2+ + 2ClO— === CaSO3↓+ 2HClO
B.向NH4HCO3 溶液中加入足量Ba(OH)2溶液
NH4+ +HCO3— + 2OH— === H2O + CO32— + NH3·H2O
C.向FeCl2溶液中加足量溴水
2Fe2+ + Br2 === 2Fe3++ 2Br—
D.NaAlO2溶液中通入过量CO2
2AlO2— +CO2+3H2O===2Al(OH)3↓+CO32—
15.碳与浓硫酸共热产生的气体X和铜与浓硝酸反应产生气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如右图装置),下列说法正确的是( )
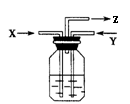 A.洗气瓶中会产生碳酸钡沉淀
A.洗气瓶中会产生碳酸钡沉淀
B.在Z导管出来的气体中无二氧化碳
C.在Z导管口有红棕色气体出现
D.洗气瓶中会产生亚硫酸钡沉淀
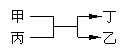 16.甲、乙为短周期不同主族元素组成的单质,丙、丁为氧化物,它们存在如下
16.甲、乙为短周期不同主族元素组成的单质,丙、丁为氧化物,它们存在如下
转化关系, ,满足条件的甲和乙为 ( )
A.铝和铁 B.氟气和氧气 C.碳和硅 D.镁和碳
17.已 知化学反应C(s)+![]() O2(g)==CO(g);△H=
— Q1 kJ/mol,
O2(g)==CO(g);△H=
— Q1 kJ/mol,
2CO (g)+O2(g)==2CO2(g);△H= — Q2 kJ/mol。
据此推断,下列说法正确的是(Q1、Q2均为正数,且其他条件相同) ( )
A.碳的燃烧热为Q1 kJ/mol
B.2molCO(g)所具有的能量一定高于2molCO2(g)所具有的能量
C.一定质量的碳燃烧,生成CO2(g)比生成CO(g)时放出的热量多
D.碳燃烧生成CO2气体的热化学方程式为:
C(s)+ O2(g)==CO2(g);△H= —(Q1 +Q2)kJ/mol
18.某溶液中大量存在五种离子:NO3—、SO42—、Fe3+、H+、X,其物质的量之比为:n(NO3—)∶n(SO42—)∶n(Fe3+)∶n(H+)∶n (X) = 2∶3∶1∶3∶1,则X可能为 ( )
A.Fe2+ B.Mg2+ C.Cl- D.Ba2+
19.氮化铝(AlN)具有耐高温、抗冲击、导电性能好等优良性能,被广泛应用于电子工业、陶瓷工业等领域,在一定条件下,氮化铝可通过如下反应合成
Al2O3+N2+3C===2AlN+3CO,下列叙述正确的是 ( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2mol AlN,电子转移3mol
C.氮化铝晶体属于分子晶体
D.氧化剂与氧化产物的物质的量比为1∶3
20.下列化合物中,不能通过化合反应而得到的是 ( )
A.SO3 B.NaHCO3 C.Al(OH)3 D.Fe(OH)3
21.下列画有横线的物质,在反应中能被完全消耗的是 ( )
A.将含少量H2O(g)的H2通过盛有足量Na2O2容器中,并不断用电火花点燃
B.将1molCu置于含2molH2SO4的浓硫酸中加热
C.将相同条件下的等体积的NO和O2混合后通入足量水中充分反应
D.将2molSO2和4molO2投入450℃并盛有催化剂的密闭容器中反应
22.几种短周期元素的主要化合价及原子的原子半径数据见下表:
| 元素代号 | L | M | Q |
| T | ||
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | -2 | ||
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
据表中信息判断,下列有关叙述中,正确的是 ( )
A.L、M的单质分别与同浓度的稀盐酸反应时,M的单质反应更剧烈
B.M与T形成的化合物能和强酸、强碱反应
C.Q、T两元素的氢化物热稳定性比较:Q的氢化物大于T的氢化物
D.L与R两元素形成的化合物中,含有共价键
23.在一定条件下,RO3—与R—可发生反应:RO3— +5R— +6H+===3R2+3H2O。下列关于R元素的叙述中,正确的是 ( )
A.R元素位于周期表中ⅤA族 B.R原子最外层有7个电子
C.RO3—中的R只能被还原 D.R2在常温常压下一定是气体
 24.H2SO4、Al2(SO4)3和MgSO4的混合溶液
24.H2SO4、Al2(SO4)3和MgSO4的混合溶液
中,加入NaOH溶液时,其沉淀的质量
W和加入的NaOH体积V之间的关系
如图所示,则原混合溶液中Al3+、Mg2+
和SO42—的物质的量之比为 ( )
A.1∶1∶1 B.5∶3∶2
C.2∶1∶5 D.3∶2∶2
25.已知0.2molCu2S与200mL 6.5mol/L的硝酸恰好完全反应,生成硝酸铜、硫酸、水和一种含氮物质,则该含氮物质的化学式为 ( )
A.N2O B.NO C.NH4NO3 D.NO2
|
二、填空题 (60分)
26.(16分)已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增。A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小。则:
(1)A是 ,D是 , E是 。
(2)在A至F中任选元素,写出二种含极性键的非极性分子的结构式 ,写出一种含非极性键的离子化合物的电子式 。
(3)由B和D组成,且B和D的质量比为3∶8的化合物的电子式是 ,
该物质与E的同周期相邻主族元素的单质反应的化学方程式为
(4)F单质与E的最高价氧化物的水化物反应的离子方程式为 。
(5)将8g BA4完全燃烧后恢复到室温,放出热量a kJ,写出表示BA4的燃烧热的热化学方程式
27.(13分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。有的反应中反应物和生成物未全部给出,反应条件也未注明。
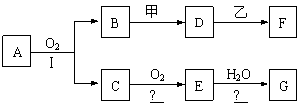 |
(1)若A为硫酸工业的重要原料,C能使品红褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成,A和乙含一种相同的元素。则
①A的的化学式为 ,工业上反应Ⅱ在 中进行(填设备名称),工业上反应Ⅲ用于吸收E的试剂是 。
②用烧碱溶液检验F溶液中所含阳离子时观察到的现象为
其中发生了氧化还原反应的化学方程式为
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①写出B和甲反应的化学方程式_______________________。
②写出D溶液与乙反应的离子方程式
③E→G的化学方程式: ________________________________________。
28.(13分)
(1)已知下列反应在一定条件下可以发生:
H2O2 + 2Fe2+ + 2H+ == 2Fe3+ + 2H2O
H2O2 + 2Fe3+ == 2Fe2+ + O2↑+ 2H+
在以上反应中Fe2+实际上起着 作用,总反应式为
(2)I2与Fe2+一样也能发生上述类似反应,类比(1)写出合适的化学反应方程式:
H2O2 + I2 == 2HIO ,总反应式为
(3)在H2SO4和KI的混合溶液中加入足量的H2O2,溶液呈棕色,并可以使淀粉溶液变蓝,写出该反应的离子方程式 ,
反应过程中同时还放出大量的无色气体A2,请说明A2是何物质,它是如何生成的? 。
有同学认为上述棕色溶液和无色气体A2的生成,可用一个离子方程式表示为:
H2O2 + 2I— === I2 + A2↑+2H+,请用氧化还原反应知识判断该方程式的正误并说明理由(若认为正确,不必说明理由) 。
29.(18)资料显示:“氨气可在纯氧中安静燃烧,……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
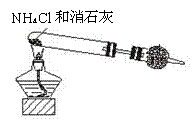
Ⅰ

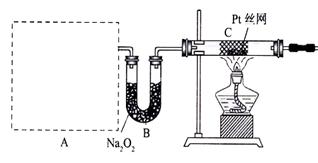
Ⅱ
(1)若用装置Ⅰ制取纯净、干燥的氨气,大试管发生的反应化学方程式是 ,干燥管中盛装的物质是 。
(2)若按装置Ⅱ进行实验,A处是气体发生装置,A中所用实验药品从下列物质中选取:(a)Na2CO3 (b)NaHCO3 (c)NH4HCO3 (d)NH4Cl (e)Ca(OH)2 (f)浓氨水, 要求进入装置C(Pt丝网作催化剂)中的气体是氨气与纯净的氧气,加热发生反应。
回答下列问题:
①若A中制取气体时只用一种药品,该药品为 (填备选药品的序号)。
②B装置的作用为 。
| |
④反应发生后,装置D中气体变为红棕色,则装置E中Cu片发生的反应离子方程式为 。
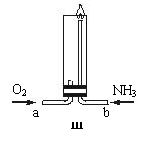 (3)将过量的纯氧与装置Ⅰ产生的氨气分别从a、b
(3)将过量的纯氧与装置Ⅰ产生的氨气分别从a、b
两管进气口通入到装置Ⅲ(见右图)中,并在b
管上端点燃氨气,氨气安静燃烧并生成无污染物
质,则:
①两气体通入的先后顺序是 ,
其理由是 。
![]() ②氨气燃烧的化学方程式是
②氨气燃烧的化学方程式是
参考答案
一、选择题(每题2分,共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | B | A | B | C | C | D | A | D | C | A | B | D |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| D | C | C | D | C | B | D | C | A | B | B | C | A |
|
26.(16分)
(1) H , O, Na(各1分)
|
(各2分)
|
(3) ,(2分)
2Mg+CO2====2MgO+C(2分)
|
(4)Cl2 +2OH— ==== H2O + Cl— + ClO—,(2分)
(5) CH4(g)+2O2(g)=CO2(g)+ 2H2O(1);△H=-2akJ/mol(3分)
27.(13分)
(1)①FeS2、接触室;98.3%的硫酸(或浓硫酸)…(各1分)
②生成白色沉淀迅速变为灰绿色,最后变为红褐色
4Fe(OH)2+O2+2H2O===4Fe(OH)3(各2分)
(2)①2Na2O2+2H2O=4NaOH+O2↑…………(2分)
②2Al+2OH—+2H2O=2AlO2—+3H2↑……… (2分)
③3NO2+H2O===2HNO3+NO(2分)
28.(13分)
(1)催化 (1分), 2H2O2 === 2H2O + O2↑ (2分)
|
2H2O2 === 2H2O + O2↑ (2分)
(3)) H2O2 + 2I— + 2H+ == I2 + 2H2O ,
A2是O2,是因为H2O2在I2的催化作用下发生分解生成的 (各2分)
方程式中碘和氧元素化合价均升高,无元素化合价降低 (2分
29.(18分)
|
(1)Ca(OH)2 + 2NH4Cl === CaCl2 +2NH3↑+ 2H2O (2分)
碱石灰。(2分)
(2)① (c) (2分)
|
③4NH3 + 5O2 ======= 4NO + 6H2O(2分)
④3Cu +8H+ + 2NO3— ====3Cu2+ + 2NO↑+ 4H2O; (2分)
(3)① 先通入O2,后通入NH3 ,(2分)
|
②
注意:
1.书写方程式时:化学式写错或未配平均不给分;必要的条件、“↑”、“↓”,每漏或错一
项扣1分,扣完为止。
2.离子方程式写成化学方程式不给分,反之也不给分。
3.计算题的计算结果漏或错写单位扣1 分
4.简答题按要点给分